Última Información
- Principios Activos
- Alertas
- Problemas Suministro
- Actualización monografías Principios Activos
- Noticias
Sospechas de reacciones adversas notificadas con tratamientos utilizados en COVID-19
VADEMECUM - 26/05/2020 COVID19Desde los Centros Autonómicos de Farmacovigilancia y la Agencia Española de Medicamentos y Productos Sanitarios agradecen a los profesionales sanitarios el esfuerzo de notificar las sospechas de reacciones adversas, en particular aquellas que surgen con los tratamientos que se están utilizando en COVID-19.
1. Contenido, interpretación y presentación de los datos 2. Casos de sospechas de reacciones adversas notificados en España con tratamientos para COVID-19 3. Hallazgos más relevantes 4. Recomendaciones para la notificación de sospechas de reacciones adversas a medicamentos para el tratamiento de la COVID-19 5. Autores
6. Bibliografía 1. Contenido, interpretación y presentación de los datos El Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano (SEFV-H), integrado por los Centros Autonómicos de Farmacovigilancia y coordinado por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), está realizando un seguimiento estrecho de las sospechas de reacciones adversas notificadas con fármacos considerados estrategias terapéuticas potenciales para la infección de SARS-CoV-21. Los medicamentos que se están revisando son los siguientes: remdesivir, lopinavir/ ritonavir, hidroxicloroquina, cloroquina, tocilizumab, sarilumab, ruxolitinib, siltuximab, baricitinib, anakinra, interferón beta-1B e interferón alfa-2B. La base de datos de sospechas de reacciones adversas, denominada FEDRA, recoge todos los casos que los profesionales sanitarios o la ciudadanía notifica en España, bien sea a través de su centro autonómico de farmacovigilancia, o a través de la industria farmacéutica. FEDRA no recoge casos procedentes de ensayos clínicos. El principal objetivo de la notificación de sospechas de reacciones adversas a medicamentos (RAM) es el de servir como sistema ágil y rápido de identificación de posibles reacciones adversas no identificadas previamente, o cambios en la forma de presentación de reacciones adversas ya conocidas. En la actualidad no hay ningún tratamiento autorizado indicado para la COVID-19. Se están empleando moléculas de nuevo desarrollo (ej. remdesivir) o medicamentos autorizados en otras indicaciones, algunos de ellos con pautas de administración diferentes a las autorizadas (ej. hidroxicloroquina). Adicionalmente las características basales de los pacientes con COVID-19 difieren de las de aquellos otros que utilizan estos fármacos en sus indicaciones autorizadas, pudiendo afectar también al perfil de reacciones adversas de estos fármacos en dichos pacientes. En esta situación, la información de seguridad disponible es muy escasa, siendo de gran importancia generar de manera precoz información sobre la seguridad de estos tratamientos.
2. Casos de sospechas de reacciones adversas notificados en España con tratamientos para COVID-19 Hasta el 17 de mayo de 2020 se han registrado en FEDRA un total de 182 casos de sospechas de reacciones adversas en pacientes con COVID-19 tratados con los fármacos objeto de seguimiento. De los 182 casos, 168 (92%) han sido notificados directamente a los Centros Autonómicos de Farmacovigilancia y el 8% restante a través de la industria farmacéutica. La mayoría han sido comunicados por profesionales sanitarios (175 casos, 96%) y 9 casos (5%) proceden de estudios. De los 182 casos, 115 proceden de un hospital con un sistema de farmacovigilancia activa que revisa resultados analíticos para detectar posibles reacciones adversas, lo que explica que algunas reacciones adversas estén sobrerrepresentadas como ocurre en los trastornos hepáticos. La mayoría de los pacientes eran adultos (63%) o mayores de 65 años (36%). El 79% de los casos corresponden a varones. Generalmente los pacientes con COVID-19 reciben combinaciones de varios medicamentos y se pueden considerar sospechosos de haber producido la reacción adversa a todos ellos, sólo a algunos o incluso a otros medicamentos que el paciente estuviera tomando. De los casos notificados, hidroxicloroquina aparece registrado como medicamento sospechoso en 145 casos, tocilizumab en 55, lopinavir/ritonavir en 51, remdesivir en 5, interferón beta 1B en 4, cloroquina en 3, baricitinib en 1 y anakinra en otro caso. No se han recibido notificaciones con interferón alfa 2B, ruxolitinib, sarilumab ni siltuximab. Cabe esperar que los fármacos que más se administran sean los más notificados por lo que un mayor número de casos notificados no es indicativo de mayor riesgo.
La tabla 1 muestra la distribución de los casos para los medicamentos en seguimiento en los que constaba COVID-19 como indicación terapéutica, incluyendo sus combinaciones más frecuentes. Además de estos medicamentos en seguimiento, esta tabla incluye la azitromicina dado que se emplea frecuentemente junto con la hidroxicloroquina. Cabe destacar que también otros fármacos que tomaba el paciente se han considerado en algunos casos sospechosos de haber producido la reacción; estos no se incluyen en la tabla y los más frecuentes han sido ceftriaxona (45 casos), enoxaparina (14 casos), levofloxacino (8 casos) y paracetamol (8 casos).
De los 182 casos registrados en este periodo, 172 son graves2 (95%), ya que la notificación de los mismos es prioritaria frente a los casos menos graves. En ellos se describen 333 términos de sospechas de reacciones adversas. Hay que tener en cuenta que un caso puede incluir más de una sospecha de reacción adversa. En la figura 1 se muestra la distribución de todas las sospechas de reacciones adversas agrupadas por órgano o sistema incluidas en las notificaciones para cada uno de los fármacos en seguimiento cuando se han utilizado para el tratamiento de la COVID-19. 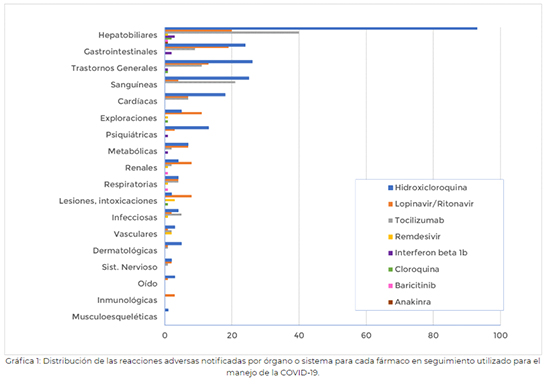 3. Hallazgos más relevantes f) Pancreatitis a) Arritmias cardíacas Se han comunicado 18 casos de arritmias cardíacas que incluyen 21 términos de sospechas de reacciones adversas: Síndrome QT largo (8), bloqueo auriculoventricular de primer grado (1), bloqueo de rama derecha (1), aleteo auricular (2), arritmia supraventricular (1), fibrilación auricular (1), bradicardia (3), taquiarritmia (1), taquicardia ventricular (1), parada cardiorrespiratoria (1), y shock cardiogénico (1) (ver Figura 2). En 7 de los 18 casos el paciente falleció (4 de ellos de muerte súbita). Seis pacientes se recuperaron en el momento de la notificación, dos estaban en recuperación, uno no se había recuperado y en dos casos se desconoce el desenlace. El rango de edad de los pacientes fue de 39 a 95 años y 13 de los 18 casos notificados ocurrieron en pacientes varones. En 9 casos hay información sobre los antecedentes cardiacos de los pacientes: cardiopatía isquémica (2), miocardiopatía hipertensiva (1), hipertensión arterial (4), sin antecedentes (2). De los 18 casos, 17 recibían hidroxicloroquina junto con otros fármacos que pueden causar alargamiento del intervalo QT (azitromicina en 13 de ellos) o bien presentar una interacción farmacocinética que incrementa el riesgo (lopinavir/ritonavir en 7 casos). Por otra parte, 4 pacientes recibían otros fármacos con actividad arritmogénica conocida. El tiempo transcurrido entre el inicio del tratamiento con hidroxicloroquina y la aparición de la arritmia estaba comprendido entre 1 y 15 días. El 22 de abril, la AEMPS publicó una nota informativa MUH (FV), 7/2020 sobre cloroquina e hidroxicloroquina advirtiendo sobre el riesgo de aparición de trastornos del ritmo3.
b) Trastornos psiquiátricos Durante el periodo de seguimiento se han notificado 11 casos que incluyen 16 términos de sospechas de reacciones adversas psiquiátricas (ver Figura 3). En 9 casos la reacción adversa fue grave, 8 de ellos en pacientes que estaban en tratamiento con hidroxicloroquina. El caso restante es un cuadro de alucinaciones asociado a interferón beta-1B. Los dos casos no graves corresponden a un caso de insomnio y otro de ansiedad, ambos en pacientes tratados con lopinavir/ritonavir. Los 8 casos graves con hidroxicloroquina fueron: suicidio consumado (4), psicosis aguda con intento de suicidio (1), comportamiento psicótico (1), alteración de conducta con agresividad (1) e intento de suicidio con pensamientos intrusivos (1). En cuatro casos el paciente falleció, dos pacientes se recuperaron tras la retirada de la hidroxicloroquina, uno no se recuperó y en otro se desconoce el desenlace. Todos eran varones, de edades comprendidas entre los 26 y los 86 años. Las reacciones adversas aparecieron mayoritariamente entre 2 y 5 días tras el inicio del tratamiento. De los 8 pacientes, 4 no tenían antecedentes psiquiátricos, en otros tres se desconoce esa información y en un caso se trata de un paciente con discapacidad intelectual y una dudosa alteración conductual previa. En 7 casos el único medicamento considerado sospechoso de haber producido la reacción es la hidroxicloroquina. En seis casos los pacientes recibían tratamiento concomitante con medicamentos relacionados con ideación suicida u otros trastornos psiquiátricos. El 14 de mayo, la AEMPS actualizó la nota informativa MUH (FV), 7/2020 sobre cloroquina e hidroxicloroquina advirtiendo del riesgo de aparición de trastornos neuropsiquiátricos graves4.
c) Trastornos hepáticos Se han notificado 100 casos de trastornos hepáticos con medicamentos utilizados en COVID-19 que describen 106 reacciones adversas, en las que interviene mayoritariamente hidroxicloroquina (87%) como sospechoso y sobre todo en combinación con otros fármacos. La hepatitis es la más frecuente (76 hepatitis, 11 hepatitis agudas, 1 hepatitis colestásica) (ver Figura 4). En el 98 % de los pacientes se consideró que las sospechas de reacciones adversas eran graves. La mayoría (75%) eran adultos y el rango de edad de los pacientes fue de 9 a 89 años. El 82% de los casos ocurrieron en pacientes varones. Las reacciones aparecieron entre 1 y 30 días tras el inicio del tratamiento. En 12 casos el paciente estaba recuperado en el momento de la notificación, en 51 estaban recuperándose, 1 paciente falleció y el resto no se habían recuperado o el desenlace fue desconocido. En 18 de los casos se registró también empeoramiento de la enfermedad, por haberse observado analíticas previas en las que la función hepática ya estaba alterada. La mayoría de estos casos (88%) proceden de un único hospital que tiene implantado un sistema de farmacovigilancia activa que consiste en la revisión de resultados analíticos para detectar posibles reacciones adversas, lo que explica que los trastornos hepáticos estén sobre representados con respecto al total de notificaciones recibidas. Se han descrito alteraciones hepáticas asociadas a la propia infección por COVID-195,6. Las fichas técnicas7 de los medicamentos que contienen hidroxicloroquina, lopinavir/ritonavir, azitromicina, ceftriaxona y tocilizumab recogen alteraciones de la función hepática, incluyendo la mayoría de ellas hepatitis o fallo hepático agudo. El material sobre prevención de riesgos de tocilizumab advierte de que se han observado casos graves de daño hepático en pacientes en tratamiento8. d) Trastornos hematológicos Se han comunicado 24 casos que describen 33 términos de sospechas de reacciones adversas (ver Figura 5). La mayoría de estos casos (75%) proceden de un único hospital que tiene implantado un sistema de farmacovigilancia activa que revisa resultados analíticos de los pacientes para detectar posibles reacciones adversas. Las reacciones adversas ocurrieron entre 1 y 23 días tras el inicio del tratamiento. Todos los casos fueron graves. Tres de los pacientes fallecieron, 7 no se habían recuperado, 6 estaban en recuperación, 7 se recuperaron en el momento de la notificación; en el caso restante se desconocía esta información. El rango de edad de los pacientes fue de 21 a 80 años. De los 24 casos, 16 pacientes (67%) eran varones. De las sospechas de reacciones adversas hematológicas notificadas, caben destacar las siguientes: Nueve casos de hipofibrinogenemia; en 8 constaba la administración de tocilizumab, siendo en 3 el único fármaco sospechoso. En 5 de los casos se había administrado hidroxicloroquina. La hipofibrinogenemia es una reacción adversa conocida para tocilizumab de aparición frecuente Cuatro casos de trombocitopenias y 1 de trombocitopenia inmune. En 4 de ellos el paciente estaba en tratamiento con hidroxicloroquina, siendo la trombocitopenia una reacción adversa conocida para este fármaco. Cuatro casos de neutropenia, 2 en pacientes que recibían hidroxicloroquina, 1 en un paciente que recibía tocilizumab y otro en un paciente que recibía ambos fármacos. Para la hidroxicloroquina está descrita la posibilidad de aparición de leucopenia y para tocilizumab la de neutropenia. En 4 de los casos se retiró el tratamiento, encontrándose el paciente en recuperación en el momento de la notificación. Cuatro casos de disminución de la coagulabilidad y dos de coagulopatía, figurando en 4 de ellos tocilizumab como fármaco sospechoso de haber producido estos cuadros. Como se ha comentado, la hipofibrinogenemia es una reacción adversa conocida para tocilizumab, condición que puede afectar a la coagulabilidad. Adicionalmente, se han notificado 2 casos de anemia hemolítica, 2 de anemia y 1 de anemia junto a hemorragia gastrointestinal. En todos los casos se incluyen como fármacos sospechosos tanto tocilizumab como hidroxicloroquina, excepto en uno de ellos en el que no consta la administración de tocilizumab. En ninguno de los 2 casos notificados de anemia hemolítica figura si los pacientes presentaban déficit de glucosa-6-fosfato-deshidrogenasa. e) Trastornos renales Se han notificado 11 casos que describen 11 reacciones adversas de trastornos renales. La mayoría de las reacciones notificadas renales corresponden al término lesión renal aguda, seguido del término anuria. (ver Figura 6). Todas ellas se consideraron graves. Las reacciones adversas renales aparecieron entre 2 y 20 días del comienzo del tratamiento considerado sospechoso. Uno de los pacientes falleció, 4 no estaban recuperados en el momento de la notificación, 2 se recuperaron, 2 estaban en recuperación; en los 2 casos restantes el desenlace era desconocido. La mayoría de los pacientes fueron adultos (45%) con un rango de edad de 21 a 80 años siendo el 82% varones. Dos de los pacientes tenían antecedentes de trastornos renales. El fármaco sospechoso más frecuentemente implicado fue lopinavir/ritonavir, si bien en la mayoría de los casos aparece en combinación con otros medicamentos. En dos de los pacientes el tratamiento fue administrado por sonda nasogástrica y se ha considerado también sospechoso el propilenglicol de la solución oral. La insuficiencia renal está descrita en la ficha técnica de los medicamentos que contienen lopinavir/ritonavir, aunque no se puede descartar la contribución de la propia enfermedad. Se ha recibido, un caso de fracaso renal e hipotensión con remdesivir. Aunque el perfil de seguridad de remdesivir no está aún bien caracterizado, los trastornos renales se han considerado como eventos de especial interés para este fármaco. También se registra un caso de lesión renal aguda en un paciente que recibía baricitinib, cuyo desenlace fue mortal; se trata de una reacción adversa no descrita en ficha técnica de este medicamento. f) Pancreatitis Se han notificado 2 casos de pancreatitis aguda, siendo tocilizumab el fármaco sospechoso, además de otra medicación. Uno de los pacientes se recuperó el otro no se había recuperado en el momento de la notificación. La pancreatitis ocurrió al día siguiente del iniciar el tratamiento en un paciente y 7 días después en el otro. La pancreatitis aguda no es una reacción adversa conocida para tocilizumab y en ambos casos existen otros medicamentos sospechosos de causarla. En uno de ellos, el paciente estaba recibiendo lopinavir/ritonavir y cursó con pancreatitis e hipertrigliceridemia, siendo esta última un factor de riesgo para el desarrollo de la pancreatitis. La pancreatitis y el aumento marcado de triglicéridos se encuentran descritos como reacciones frecuentes para lopinavir/ritonavir. 4. Recomendaciones para la notificación de sospechas de reacciones adversas a medicamentos para el tratamiento de la COVID-19 Se anima a los profesionales sanitarios y a la ciudadanía a notificar las sospechas de reacciones adveras relacionadas con tratamientos utilizados en COVID-19. Para ello, recomendamos el uso del formulario www.notificaRAM.es, así como cualquier otro medio puesto a disposición por su Centro Autonómico de Farmacovigilancia. Para ayudar a interpretar correctamente las notificaciones, es importante reflejar correctamente la siguiente información: - Edad y sexo del paciente. - Nombre del medicamento, dosis y duración e indicación. Indicar si se trata de tratamiento o profilaxis. Además de los medicamentos sospechosos es conveniente incluir otros medicamentos que pudiera estar tomando el paciente en el mismo periodo. - Antecedentes clínicos relevantes y estado del paciente debido al COVID-19 en el momento de la reacción adversa (ingresado en UCI, ingresado en planta, paciente ambulatorio). - Descripción de la reacción adversa con fecha de inicio y finalización, así como el desenlace de la misma en el momento de la notificación. 5. Autores Grupo de Trabajo del CTSEFV-H para el seguimiento casos de sospechas de RAM notificados en tratamientos para infección por SARS-CoV-2 (Centros Autonómicos de Farmacovigilancia de Andalucía, Canarias, Cataluña, Comunidad Valenciana, Extremadura, Murcia, Navarra, País Vasco y División de Farmacoepidemiología y Farmacovigilancia de la AEMPS). 6. Bibliografía 1Tratamientos disponibles para el manejo de la infección respiratoria por SARS- CoV-2, (actualizado a 16 de abril de 2020) https://www.aemps.gob.es/la-aemps/ultima-informacion-de-la-aemps-acerca-del-covid%e2%80%9119/tratamientos-disponibles-para-el-manejo-de-la-infeccion-respiratoria-por-sars-cov-2/ 2Caso grave: cuando resulta mortal, pone en peligro la vida, requiere o prolonga hospitalización, da lugar a una discapacidad significativa o persistente, o a una malformación congénita, y también cualquier otra condición médicamente significativa. 3Nota informa de Seguridad de la AEMPS: MUH /FV) 7/2020 actualización 14 de mayo: Cloroquina/Hidroxicloroquina: precauciones y vigilancia de posibles reacciones adversas en pacientes con COVID-19 4Nota informa de Seguridad de la AEMPS: MUH /FV) 7/2020 actualización 14 de mayo: Cloroquina/Hidroxicloroquina: precauciones y vigilancia de psoibles reacciones adversas en pacientes con COVID-19 5Chao Zhang, Lei Shi, Fu-Sheng Wang. Liver injury in COVID-19: management and challenges. www.thelancet.com/gastrohep Vol 5 May 2020. Published Online March 4, 2020 https://doi.org/10.1016/ S2468-1253(20)30057-1 6Ling Xu, Jia Liu, Mengji Lu, Dongliang Yang, Xin Zheng. Liver injury during highly pathogenic human coronavirus infections. Liver International. 2020; 00: 1–7 7CIMA (Centro de Información de Medicamentos de la AEMPS): https://cima.aemps.es/cima/publico/home.html INFORMACIÓN IMPORTANTE DE SEGURIDAD DIRIGIDA A LOS PROFESIONALES SANITARIOS. Disponible en: Anteriores versiones del documento: Sospechas de reacciones adversas notificadas con tratamientos utilizados en COVID-19 (Publicado el 14 de mayo de 2020) |
| Enlaces de Interés | ||||
|
|
|||

