Informe de Posicionamiento Terapéutico de elosulfasa alfa (Vimizim®)
Informe de Posicionamiento Terapéutico de elosulfasa alfa (Vimizim®)
Fecha de publicación: 31 de mayo de 2016
La mucopolisacaridosis tipo IV A o enfermedad Morquio A se produce como consecuencia de una alteración genética de la enzima lisosómica N-acetilgalactosamina-sulfato 6-sulfatasa que conlleva un acumulo de glicosaminoglicanos en los lisosomas de diversos órganos y tejidos, produciendo fundamentalmente displasias esqueléticas y alteraciones en la función respiratoria (1). Es una enfermedad hereditaria que tiene una prevalencia de 0,06 por cada10.000 nacimientos vivos en Europa, lo que correspondería a unos1.300 pacientes en Europa (2). Se asocia a importantes limitaciones de la movilidad y de la función respiratoria, pudiendo acabar en fallorespiratorio entre los 20 y 60 años de edad, según la progresión de laenfermedad.
Actualmente, el tratamiento de estos pacientes es sintomático, incluyendo cirugía correctiva (1).
ELOSULFASA ALFA (VIMIZIM®)
Elosulfasa alfa está indicado para el tratamiento de la mucopolisacaridosis tipo IV A en pacientes de todas las edades.
Debido a la prevalencia de la enfermedad ha sido designado medicamento huérfano por la Agencia Europea de Medicamentos (3).
Farmacología
La elosulfasa alfa es una forma recombinante de la N- acetilgalactosamina 6-sulfatasa humana que llega hasta los lisosomas para ejercer su función: degradar glicosaminoglicanos, como el condroitín sulfato y queratán sulfato, evitando su acúmulo celular.
La dosis recomendada de elosulfasa alfa es de 2mg/kg de peso corporal administrado una vez a la semana en perfusión intravenosa de aproximadamente 4 horas de duración. Debe tenerse especial precaución con la posible aparición de anafilaxis y reacciones alérgicas graves, así como a otras reacciones asociadas a la perfusión.
Eficacia
Se dispone de 8 ensayos clínicos realizados con elosulfasa alfa en pacientes con mucopolisacaridosis tipo IV A. De entre estos, los más relevantes son el estudio pivotal MOR-004 y su estudio de extensión MOR-005 (actualmente en marcha).
Existe también un estudio de la historia natural de la enfermedad MOR-001 y un estudio en fase 2 (MOR-6), ambos en marcha y con datos demasiado prematuros aún como para poder considerarse a fecha de elaboración de este informe.
El estudio pivotal MOR-004 fue un estudio aleatorizado, doble ciego, que incluyó 176 pacientes de entre 5 y 57 años con diagnóstico de mucopolisacaridosis tipo IV A candidatos a recibir placebo o elosulfasa alfa, bien en un régimen de 2mg/kg cada dossemanas o bien en un régimen de 2 mg/kg semanal, durante 24 semanas.
La variable principal del estudio fue el cambio en el test de la marcha de los 6 minutos (TM6M) desde el inicio del estudio hasta la semana 24 de tratamiento. Adicionalmente se estudiaron variables secundarias y terciarias entre las que se incluyeron el Test de subir escaleras en 3 minutos, la reducción de glicosaminoglicanos en orina, pruebas funcionales respiratorias o evaluaciones de la calidad de vida, entre otros.
Al comienzo del estudio, los valores basales de TM6M fueron de entre 36 y 322 metros (m) (en un 61 % de los pacientes >200m).
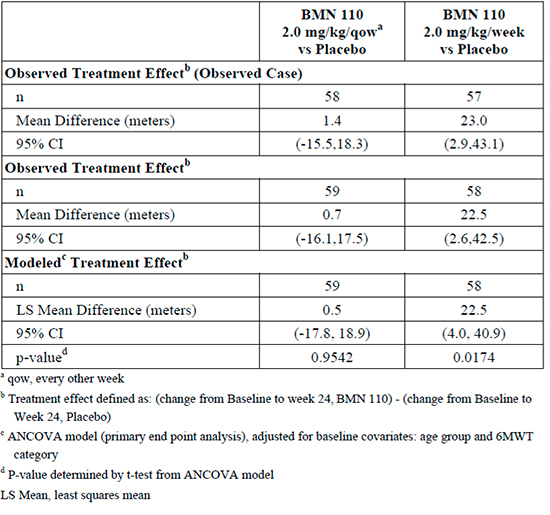
En relación al análisis de la variable principal de eficacia, se observó una diferencia media de 22,5m [IC95 % (4; 40,9) p=0,0174] entre la pauta de elosulfasa semanal y placebo. Dichadiferencia favorable a la pauta semanal de elosulfasa fue estadísticamente significativa.
Tabla 1. Primary Efficacy Analysis Mean Absolute Change fromBaseline in 6MWT at Week 24 (ITT Population)
En cuanto a las variables secundarias y terciarias (estudio MOR-004), el test de subir escaleras en 3 minutos, la reducción en los niveles de orina de queratán sulfato, parámetros antropométricos, eltest de calidad de vida de mucopolisacaridosis así como parámetros respiratorios (ventilación voluntaria máxima y capacidad vital forzada) mostraron en el régimen semanal una tendencia numérica a favor de elosulfasa-alfa en relación a placebo, pero sin llegar aobtener significación estadística en todos los casos.
Respecto a la eficacia a más largo plazo, el estudio MOR-005 es el estudio de extensión del ensayo fase III, actualmente en marcha, para evaluar los efectos de elosulfasa hasta las 240 semanas en 173 individuos que completaron el ensayo pivotal. En la primera parte del estudio, los individuos que inicialmente recibieron la pauta de2mg/kg/semana o 2mg/kg/bisemanal continuaron con el mismo tratamiento y los que habían recibido placebo se aleatorizaron 1:1 a una de las dos pautas de elosulfasa. En la segunda parte del estudio,actualmente en marcha, todos los individuos pasaron a recibir2mg/kg/semanal debido a los resultados obtenidos en el estudio pivotal.
En cuanto a los resultados disponibles del estudio MOR-005, en la cohorte de pacientes que recibieron desde el inicio el tratamiento con 2mg/kg/semanal mostraron una mejoría en el TM6M a la semana 36, pero esta no se mantuvo, ya que a la semana 48, en la población por intención de tratar, los resultados del TM6M fueron similares a los observados en la semana 24 al final del estudio pivotal (en la población con intención de tratar, el cambio medio en el TM6M en la semana 36 respecto al inicio del estudio fue de 42,2 m y de 33,4 m en la semana 48).
Aún no se dispone de datos en pacientes menores de 5 años de edad, ya que el estudio en fase II que los evalúa está actualmente en marcha.
Seguridad
Cincuenta y dos pacientes estuvieron expuestos más de 48 semanas al régimen semanal (2).
Las reacciones adversas más frecuentes fueron cefalea, náuseas, vómitos, disnea, pirexia, mareos, escalofríos y dolor abdominal.
Además, la mayoría de los pacientes expuestos a elosulfasa alfa experimentaron al menos una reacción adversa relacionada con la perfusión, siendo éstas más frecuentes durante las 12 primeras semanas de tratamiento. Si bien las reacciones de infusión fueron generalmente de leves a moderadas y pudieron solventarse con tratamiento sintomático y modificación del ritmo de perfusión, aproximadamente un 0,8 % de los pacientes expuestos tuvieron que interrumpir/suspender el tratamiento y recibir intervención médica. De hecho, las reacciones graves, aunque infrecuentes, estuvieron principalmente relacionadas con la administración y/o la enfermedad de base.
Un 20 % de los pacientes tuvieron reacciones de hipersensibilidad con el régimen semanal como angioedema (25 %), urticaria (9 %) o edema periférico (5 %) entre otros.
No hubo muertes en los ensayos ni cambios relevantes en parámetros de laboratorio.
El 80 % de los pacientes incluidos en los ensayos clínicos desarrollaron anticuerpos neutralizantes, sin que aparentemente se relacionaran con reducciones de la eficacia de elosulfasa alfa ni con la presencia de anafilaxia u otras reacciones de hipersensibilidad.
DISCUSIÓN
La enfermedad de Morquio o MPS tipo IV A es una enfermedad grave y muy debilitante para la cual actualmente no se dispone de tratamiento específico y su abordaje se basa en el control y corrección de los signos y síntomas asociados a esta condición.
La eficacia de elosulfasa se evaluó por medio del estudio pivotal MOR-004, en el que se alcanzó el objetivo primario al evidenciarse una diferencia estadísticamente significativa de 22,5 m en el TM6M a las 24 semanas de tratamiento en favor del régimen semanal de elosulfasa (único aprobado) en comparación con placebo.
En relación a la variable principal utilizada, el TM6M se podría considerar adecuado debido a la carencia de parámetros estandarizados para el estudio de la mucopolisacaridosis tipo IV A y de las características de la enfermedad, que afecta en gran medida a la movilidad y a la función respiratoria de los pacientes. Sin embargo, no se dispone actualmente de datos de elosulfasa alfa sobre el pronóstico de la enfermedad en términos de variables más robustas de morbi-mortalidad en los ensayos clínicos (tiempo hasta dependencia de silla de ruedas, soporte respiratorio o intervenciones quirúrgicas correctoras, entre otras).
Adicionalmente, existe incertidumbre en relación a la magnitud del efecto mostrada debido a la amplia variabilidad observada en elcambio del test de la marcha de 6 minutos respecto de los valores basales. En este sentido, la amplia heterogeneidad de la muestra de pacientes incluidos en el estudio, como queda reflejado en las diferencias de las características basales de los pacientes en relación a dicha variable, tampoco permite establecer si existen subgrupos de pacientes que obtenga mayor beneficio del tratamiento con elosufasa. Asimismo, el efecto del fármaco en personas no ambulantes o en pacientes menores de 5 años (donde el beneficio podría ser potencialmente mayor) está siendo estudiado en la actualidad, por lo que se desconoce el beneficio clínico que dichos pacientes podrían obtener.
Las incertidumbres mencionadas en párrafos anteriores ponen de manifiesto la necesidad de disponer de información sobre variables de seguimiento que permitan identificar los pacientes que más puedan beneficiarse del tratamiento con elosulfasa alfa. Por otra parte, las variables secundarias analizadas sugieren un efecto positivo de la pauta semanal de elosulfasa frente a placebo pero sin llegar a obtener diferencias estadísticamente significativas en todos los casos. Asimismo, un análisis adicional post-hoc mostró que un 0% de los pacientes tratados con el régimen semanal frente un 8,8 % en placebo a la semana 24 en el estudio MOR-004 necesitaron silla de ruedas y se necesitó un menor número de cirugías ortopédicas (8% frente a 18 %) en la semana 72 y un mayor tiempo hasta cirugía con el tratamiento semanal que con placebo (estudio MOR-005).
Cabe resaltar que los datos actualmente disponibles provienen de ensayos clínicos con un tiempo de seguimiento limitado, y el efecto de elosulfasa a más largo plazo debe ser aún confirmado por medio del registro a 10 años que debe realizar la compañía, lo que enlaza con la necesidad de limitar las incertidumbres existentes mencionadas anteriormente.
En cuanto a la seguridad del fármaco, los datos actuales parecen indicar que elosulfasa alfa es bien tolerado, debiendo tener especial precaución con las reacciones relacionadas con la perfusión y reacciones anafilácticas (cuya frecuencia no es despreciable). No obstante, dichos datos son limitados al tratarse de una enfermedad rara, con sólo 52 pacientes expuestos al régimen semanal de elosulfasa durante más de 48 semanas. El registro iniciado permitirá asimismo la obtención de datos más robustos en relación a la seguridad de elosulfasa a largo plazo.
Por otra parte, de entre todos los pacientes incluidos en los ensayos clínicos, hasta un 80 % mostraron anticuerpos neutralizantes anti-elosulfasa alfa y sobre un 10 % desarrollaron IgE anti-elosulfasa alfa. Si bien este hecho, no se asoció con pérdida de eficacia ni comportó un aumento en la incidencia o severidad de reacciones de hipersensibilidad, teniendo en cuenta los datos actualmente disponibles del estudio MOR-005, parece razonable no excluir una posible relación causal entre la aparición de anticuerpos antifármaco y una atenuación de la actividad terapéutica, por lo que se deberán considerar criterios clínicos de parada de tratamiento. En este sentido, aquellos pacientes en que el tratamiento se haya iniciado por criterios de afectación de la movilidad basada en los metros recorridos durante la prueba de la marcha, la ausencia de mejoría después del primer año de tratamiento, y/o la progresión hacia la necesidad de silla de ruedas, podrían constituir motivo suficiente para la reevaluación de la indicación terapéutica por un comité de expertos. De la misma manera, en cuanto a capacidad de movilidad y crecimiento, es posible que haya pacientes que después de una mejoría evidente lleguen a una situación de estabilidad que habrá que contrastar con otros parámetros como los de función respiratoria y cardiovascular. Por otro lado, dada la rareza y heterogeneidad de esta población, es posible que exista un grupo de pacientes que no respondan al tratamiento, para lo cual habría que instaurar criterios compuestos para su identificación, basados fundamentalmente en la movilidad, función respiratoria, cardiovascular, y calidad de vida. Enestos casos es especialmente recomendable la determinación periódica de anticuerpos anti-elosulfasa para intentar establecer o refutar una relación de los mismos con la eficacia terapéutica.
En el caso de reacción anafiláctica recurrente, no fácilmentecontrolable con la medicación habitual, hay que valorar individualmente el beneficio/riesgo del medicamento paradeterminar la continuación del tratamiento.
CONCLUSIÓN
Elosulfasa alfa es el primer tratamiento autorizado para la mucopolisacaridosis tipo IV A, enfermedad grave y debilitante que actualmente se trata de manera sintomática.
Los principales resultados de eficacia se refieren a variables relacionadas con la movilidad (aumento de 22,5m en el T6M respecto a placebo), sin que se disponga de de datos de elosulfasa alfa sobre variables robustas (tiempo de inicio de necesidad de silla de ruedas, dependencia de ventilación mecánica, mortalidad).
En el momento de elaboración de este informe, la eficacia de elosulfasa no ha sido evaluada en pacientes en fases avanzadas de la enfermedad e incapaces de deambular, así como tampoco en pacientes menores de 5 años de edad (donde el beneficio del tratamiento podría ser potencialmente mayor), por lo que no es posible sacar conclusiones sobre el posible impacto del fármaco en estos grupos de pacientes.
Se hace necesaria la recogida de información sobre variables de seguimiento que permitan arrojar más luz sobre las incertidumbres existentes con el tratamiento con elosulfasa alfa con el fin de identificar aquellas poblaciones que más puedan beneficiarse del tratamiento con elosulfasa alfa.
El tratamiento con elosulfasa alfa deberá reevaluarse individualmente en caso de:
- pacientes que no respondan al tratamiento según parámetros de movilidad, función respiratoria, cardiovasculares, y de calidad de vida.
- ausencia de mejoría en el T6M al año de tratamiento y/o la progresión de la afectación ósea hacia la necesidad de silla de ruedas en aquellos pacientes en los que el tratamiento se haya iniciado por criterios de afectación de la movilidad.
- en caso de reacción anafiláctica recurrente, no fácilmente controlable con la medicación habitual.
Dicha valoración debería realizarse por un comité de expertos dada la naturaleza de la enfermedad.
Sería recomendable la determinación periódica de anticuerpos anti-elosulfasa para intentar establecer o refutar una relación de los mismos con la eficacia terapéutica, sobre todo en aquellos pacientes en los que no se aprecie una respuesta esperada.
CONSIDERACIONESFINALES DEL GCPT
La Dirección general de Cartera Básica de Servicios del SNS y Farmacia ha emitido la resolución de no financiación para Vimizim®(elosulfasa alfa).
REFERENCIAS
1. Tomatsu, S.; M. Montano, A.; Oikawa, H.; J. Rowan, Daniel; Smith, M.; Barrera, L.; Chinen, Y.; M. Thacker, M.; G. Mackenzie, W.; Suzuki, Y.; Orii, T.Current PharmaceuticalBiotechnology, Volume 12, Number 6, June 2011, pp. 931- 945(15).
2. EPAR de Vimizim disponible en: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/002779/WC500169242.pdf
3. Designación de huérfano de Vimizim disponible en:http://www.ema.europa.eu/docs/en_GB/document_library/Orphan_designation/2009/10/WC500005877.pdf.4. J. Nelson, D. Broadhead, Jean Mossman. Clinical findings in 12 patients with MPS IV A (Morquio's disease) Clin Genet.1988;33:111–120. DOI: 10.1111/j.1399-0004.1988.tb03421.x.
5. Hendriksz CJ et al. Orphanet J Rare Dis 2014; 9:32.
GRUPO DEEXPERTOS
(por orden alfabético)
Agencia Española de Medicamentos y Productos Sanitarios
Guillem Pintos
Hospital Universitario Germans Trias i Pujol. Badalona
Programa de Evaluación, Seguimiento y Financiación deTratamientos Farmacológicos de Alta Complejidad del CatSalut
Todos los expertos han realizado una declaración de conflictos de interés.
El Laboratorio Titular, la Asociación Española de Mucopolisacaridosis, Asociación Española para el Estudio de los Errores Congénitos del Metabolismo, Asociación Española de Genética Humana, Sociedad Española de Farmacología Clínica, Sociedad Española de Farmacia Hospitalaria y la Federación Española de Enfermedades Raras han tenido oportunidad de enviar comentarios al documento, si bien el texto final es el adoptado por el GCPT.
Fuente: Agencia Española de Medicamentos y Productos Sanitarios.
