Alertas
-
![]()
Fulvestrant DR. Reddys 250 mg solución inyectable en jeringa precargada EFG, 2 jeringas precargadas de 5 ml + 2 agujas (NR: 82518, CN: 719459)
13/03/2024 | ALERTAS
-
![]()
Pleinvue polvo para solución oral, 3 (1x3) sobres (NR: be518640, CN: 729190)
21/02/2024 | ALERTAS
-
![]()
Imunocare 50 mg/g crema 24 sobres unidosis de 250 mg (NR: 78406, CN: 701283)
13/02/2024 | ALERTAS
-
![]()
Metformina Vir 850 mg comprimidos recubiertos con película EFG , 50 comprimidos (NR: 72708, CN: 681987)
13/02/2024 | ALERTAS
-
![]()
Sugammadex Orion 100 mg/ml solución inyectable EFG, 10 viales de 5 ml (NR: 88751, CN: 762459)
23/01/2024 | ALERTAS
-
![]()
Sugammadex Sala 100 mg/ml solución inyectable EFG, 10 viales de 5 ml (NR: 88700, CN: 607631)
23/01/2024 | ALERTAS
-
Ver todas las alertas
Problemas de suministro
-
![]()
ALYMSYS 25 mg/ml Concentrado para sol. para perfusión env. con 1 vial de 4 ml
-
![]()
DULOXETINA ALTER 60 mg Cáps. dura gastrorresistente env. con 56
-
![]()
SULMETIN SIMPLE 150 mg/ml Sol. iny. env. con 5 ampollas de 10 ml
-
![]()
ARIPIPRAZOL MYLAN PHARMA 5 mg Comp. env. con 28
-
![]()
GLIMEPIRIDA NORMON 2 mg Comp. env. con 30 comprimidos
-
![]()
TADALAFILO MYLAN 5 mg Comp. recub. con película env. con 28
-
Ver todos los Problemas de Suministro
Actualización de monografía de principios activos
-
AVAPRITINIB (18/04/2024) MONOGRAFÍA DE NUEVO PRINCIPIO ACTIVO EN ESPAÑA
-
RIPRETINIB (17/04/2024) MONOGRAFÍA DE NUEVO PRINCIPIO ACTIVO COMERCIALIZADO EN ESPAÑA
-
RELUGOLIX (17/04/2024) MONOGRAFÍA DE NUEVO PRINCIPIO ACTIVO COMERCIALIZADO EN ESPAÑA.
-
ESPESOLIMAB (17/04/2024) MONOGRAFÍA DE NUEVO PRINCIPIO ACTIVO COMERCIALIZADO EN ESPAÑA
-
TRAMADOL Y CELECOXIB (17/04/2024) MONOGRAFÍA DE NUEVO PRINCIPIO ACTIVO COMERCIALIZADO EN ESPAÑA
-
LATANOPROST Y NETARSUDIL (17/04/2024) MONOGRAFÍA DE NUEVO PRINCIPIO ACTIVO COMERCIALIZADO EN ESPAÑA
Noticias
-
![]()
Formando en Medicina Personalizada de Precisión desde la etapa escolar
23/05/2024 | FORMACIÓN
-
![]()
La investigación dermatológica hecha en España, clave en melanoma y en enfermedades crónicas de la piel
23/05/2024 | CONGRESOS, FORMACIÓN
-
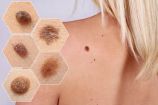
![]()
Un proyecto pionero logra prevenir la aparición del melanoma, los efectos secundarios del tratamiento oncológico y mejorar el estado psicológico de los pacientes
23/05/2024 | PATOLOGÍAS
-
![]()
El esfuerzo de compensar o camuflar sus diferencias frente a los demás causa problemas de estrés, ansiedad y frustración a las personas con trastorno del espectro autista
23/05/2024 | ASOCIACIONES MÉDICAS
-
![]()
Infertilidad inmunológica: cuando los trastornos inmunes afectan a la salud reproductiva de la mujer
22/05/2024 | TERAPIAS
-
![]()
Pamplona acoge el 40º Congreso Nacional de Medicina Nuclear que reúne a más de 500 especialistas
22/05/2024 | CONGRESOS, FORMACIÓN
-
Ver todas las noticias