KOGENATE BAYER 2000 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE
| ATC: Octocog alfa |
| PA: Octocog alfa |
| EXC: Sacarosa y otros. |
Envases
 Introducción
Introducción
Prospecto: información para el usuario
KOGENATE Bayer 250 UI Polvo y disolvente para solución inyectable
KOGENATE Bayer 500 UI Polvo y disolvente para solución inyectable
KOGENATE Bayer 1000 UI Polvo y disolvente para solución inyectable
KOGENATE Bayer 2000 UI Polvo y disolvente para solución inyectable
KOGENATE Bayer 3000 UI Polvo y disolvente para solución inyectable
Factor VIII de la coagulación de origen recombinante (octocog alfa)
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es KOGENATE Bayer y para qué se utiliza
- Qué necesita saber antes de empezar a usar KOGENATE Bayer
- Cómo usar KOGENATE Bayer
- Posibles efectos adversos
- Conservación de KOGENATE Bayer
- Contenido del envase e información adicional
 1. Qué es KOGENATE Bayer y para qué se utiliza
1. Qué es KOGENATE Bayer y para qué se utiliza
KOGENATE Bayer contiene el principio activo Factor VIII de la coagulación humano recombinante (octocog alfa).
KOGENATE Bayer se utiliza para el tratamiento y prevención de la hemorragia en adultos, adolescentes y niños de cualquier edad con hemofilia A (déficit congénito de factor VIII). Este medicamento no contiene factor de von Willebrand, por lo que no se debe utilizar en la enfermedad de von Willebrand.
 2. Qué necesita saber antes de empezar a usar KOGENATE Bayer
2. Qué necesita saber antes de empezar a usar KOGENATE Bayer
No use KOGENATE Bayer
- si es alérgico a octocog alfa o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6 y al final de la sección 2).
- si es alérgico a las proteínas de ratón o hámster.
Si tiene alguna duda sobre lo anterior, consulte a su médico.
Advertencias y precauciones
Tenga especial cuidado con KOGENATE Bayer y consulte a su médico o farmacéutico si:
- siente opresión en el pecho, sensación de mareo, vértigo o náusea, o bien se marea estando de pie, es posible que esté sufriendo una reacción alérgica repentina grave (reacción anafiláctica) rara a este medicamento. Si esto ocurre, interrumpa inmediatamente la administración del medicamento y pida asistencia médica.
- la hemorragia no se llega a controlar con su dosis habitual de este medicamento. La formación de inhibidores (anticuerpos) es una complicación conocida que puede producirse durante el tratamiento con todos los medicamentos compuestos por factor VIII. Estos inhibidores, especialmente en grandes cantidades, impiden que el tratamiento funcione correctamente, por lo que se les supervisará cuidadosamente a usted y a su hijo por si desarrollan dichos inhibidores. Si su hemorragia o la de su hijo no se está controlando con KOGENATE Bayer, consulte a su médico inmediatamente.
- ha desarrollado anteriormente inhibidores del factor VIII y cambia a otro medicamento de factor VIII, es posible que vuelva a desarrollar inhibidores.
- le han indicado que padece una enfermedad cardíaca o que tiene riesgo de padecer una enfermedad cardíaca.
- necesita un dispositivo de acceso venoso central (DAVC) para la administración de KOGENATE Bayer. Debe tener en cuenta el riesgo de complicaciones relacionadas con el DAVC, como por ejemplo, infecciones locales, presencia de bacterias en la sangre (bacteriemia) y formación de un coágulo de sangre en el vaso sanguíneo (trombosis) donde se inserta el catéter.
Su médico debe llevar a cabo las pruebas necesarias para garantizar que su dosis actual del fármaco le proporciona los niveles adecuados de factor VIII.
Uso de KOGENATE Bayer con otros medicamentos
No se conocen interacciones con otros medicamentos. No obstante, por favor, informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
Niños y adolescentes
La lista de advertencias y precauciones es aplicable a pacientes de todas las edades, adultos y niños.
Embarazo, lactancia y fertilidad
No se dispone de experiencia sobre la fertilidad ni sobre el uso de KOGENATE Bayer durante el embarazo y el periodo de lactancia. Por consiguiente, si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de utilizar este medicamento.
No es probable que KOGENATE Bayer afecte a la fertilidad de los pacientes de sexo masculino ni femenino, ya que el principio activo aparece de forma natural en el organismo.
Conducción y uso de máquinas
No se han observado efectos sobre la capacidad para conducir o utilizar máquinas.
KOGENATE Bayer contiene sodio
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por vial, por lo que se considera esencialmente “exento de sodio”.
Documentación
Se recomienda que cada vez que utilice KOGENATE Bayer, anote el nombre y el número de lote del medicamento.
 3. Cómo usar KOGENATE Bayer
3. Cómo usar KOGENATE Bayer
Siga exactamente las instrucciones de administración de este medicamento indicadas en este prospecto o las indicadas por su médico o farmacéutico. En caso de duda, consulte de nuevo a su médico, farmacéutico o enfermero.
Tratamiento del sangrado
Su médico calculará la dosis de este medicamento y la frecuencia con la que se debe administrar para alcanzar el nivel necesario de actividad del factor VIII en su sangre. Él/Ella debe ajustar siempre la dosis y la frecuencia de administración, en función de sus necesidades. La cantidad de KOGENATE Bayer que debe usar y con qué frecuencia depende de muchos factores como:
- su peso
- la gravedad de su hemofilia
- la localización y gravedad del sangrado
- si tiene inhibidores del factor VIII y la cantidad de ellos
- el nivel requerido de factor VIII.
Prevención del sangrado
Si está utilizando KOGENATE Bayer para prevenir el sangrado (profilaxis), su médico calculará la dosis que le conviene. Esta dosis será normalmente de 20 a 40 UI de octocog alfa por kg de peso corporal, administrada cada 2 ó 3 días. No obstante, en algunos casos, especialmente en pacientes más jóvenes, pueden requerirse intervalos de tratamientos más cortos o dosis superiores.
Pruebas de laboratorio
Es altamente recomendable realizar las pruebas analíticas adecuadas a intervalos apropiados para comprobar que se hayan alcanzado y se mantengan en el plasma los niveles adecuados de factor VIII. En el caso concreto de las intervenciones quirúrgicas importantes, debe realizarse un control estricto del tratamiento sustitutivo mediante pruebas de la coagulación.
Uso en niños y adolescentes
KOGENATE Bayer se puede usar en niños de todas las edades.
Si el sangrado no se controla
Si su nivel de factor VIII no alcanza los niveles esperados en el plasma, o si no se puede controlar el sangrado con una dosificación aparentemente adecuada, es posible que haya desarrollado inhibidores del factor VIII. Un médico especialista comprobará si presenta inhibidores del factor VIII.
Si estima que el efecto de este medicamento es excesivo o insuficiente, comuníqueselo a su médico.
Pacientes con inhibidores
Si su médico le dice que ha desarrollado inhibidores del factor VIII, podrá necesitar una cantidad superior de este medicamento para controlar el sangrado. Si esta dosis superior no lo controla, su médico podrá considerar la utilización de otro medicamento, el concentrado de factor VIIa o bien el concentrado de complejo protrombínico (activado).
Estos tratamientos deben ser recetados por médicos con experiencia en el cuidado de pacientes con hemofilia A. Si desea más información, hable con su médico.
No aumente la dosis de este medicamento que le han prescrito para controlar su sangrado sin consultar con su médico.
Duración del tratamiento
Su médico indicará con qué frecuencia y a qué intervalos se debe administrar este medicamento. Generalmente, el tratamiento sustitutivo con KOGENATE Bayer será necesario de por vida.
Cómo se administra KOGENATE Bayer
Este medicamento se debe inyectar en una vena durante 2 a 5 minutos dependiendo del volumen total y del grado de bienestar y se debe usar en el plazo de 3 horas después de su reconstitución.
Cómo se prepara KOGENATE Bayer para la administración
Utilice únicamente los elementos (vial con polvo y sistema Bio-Set, jeringa precargada con el disolvente y equipo para punción venosa) incluidos en el envase para este medicamento. Si no es posible utilizar estos componentes, consulte a su médico. Si alguno de los componentes del envase está abierto o dañado, no use este componente.
Debe filtrar el medicamento reconstituido antes de la administración para eliminar posibles partículas presentes en la solución. La filtración se puede realizar siguiendo los pasos para la reconstitución y/o administración descritas a continuación. Use el equipo de punción venosa suministrado, ya que contiene un filtro en línea. Si no puede usar el equipo de punción venosa suministrado, utilice un filtro indicado por su médico o enfermero.
No use el equipo de punción venosa suministrado para la extracción de sangre, porque contiene un filtro en línea. Cuando se deba extraer sangre antes de una perfusión, se usará un equipo de administración sin filtro y, a continuación, se administrará este medicamento mediante un filtro de inyección. Si tiene alguna pregunta sobre este medicamento y el uso de otros filtros compatibles, consulte a su médico.
Este medicamento no se debe mezclar con otras soluciones para perfusión. No utilice soluciones si observa partículas o si la solución está turbia. Siga estrictamente las instrucciones de administración que le dé su médico y utilice las instrucciones detalladas de reconstitución y administración recogidas al final de este prospecto.
Si usa más KOGENATE Bayer del que debe
No se han comunicado casos de sobredosis con factor VIII de la coagulación de origen recombinante. Si ha usado más KOGENATE Bayer del que debe, por favor, informe a su médico.
Si olvidó usar KOGENATE Bayer
- Aplique inmediatamente la siguiente dosis y continúe a intervalos regulares siguiendo las indicaciones de su médico.
- Nouse una dosis doble para compensar las dosis olvidadas.
Si quiere interrumpir el tratamiento con KOGENATE Bayer
No deje de usar KOGENATE Bayer sin consultarlo con su médico.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
 4. Posibles efectos adversos
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Los efectos adversos más graves son reacciones de hipersensibilidad o shock anafiláctico (efecto adverso raro).
Si se produce una reacción alérgica o anafiláctica, se debe interrumpir la inyección o perfusión y consultar a su médico inmediatamente.
En los niños que no han recibido tratamiento previo con medicamentos compuestos por factor VIII pueden producirse anticuerpos inhibidores (ver sección 2) muy frecuentemente (más de 1 de cada 10 pacientes); sin embargo, en los pacientes que han recibido tratamiento previo con factor VIII (más de 150 días de tratamiento), el riesgo es poco frecuente (menos de 1 de cada 100 pacientes). Si esto sucede, los medicamentos que toman usted o su hijo pueden dejar de funcionar correctamente y usted o su hijo pueden sufrir una hemorragia persistente. En ese caso, contacte con su médico inmediatamente.
Otros posibles efectos adversos:
Frecuentes
(pueden afectar hasta 1 de cada 10 personas):
- sarpullido con o sin picor
- reacciones locales en el lugar donde se ha inyectado el medicamento (p.ej., sensación de quemazón, enrojecimiento pasajero)
Raros
(pueden afectar hasta 1 de cada 1.000 personas):
- reacciones alérgicas incluyendo reacción alérgica repentina grave (que puede incluir ronchas, náuseas, urticaria, angioedema, escalofríos, sofocos, cefalea, letargo, sibilancias o dificultad para respirar, inquietud, taquicardia, hormigueo o shock anafiláctico, p. ej. opresión en el pecho, sensación general de malestar, mareo, náuseas y ligera bajada de tensión que puede hacer que se maree al levantarse)
- fiebre
Frecuencia no conocida
(la frecuencia no puede estimarse a partir de los datos disponibles):
- disgeusia (alteración del sentido del gusto)
Si nota cualquiera de los síntomas siguientes durante la inyección o la perfusión:
- opresión en el pecho, o sensación general de malestar
- mareo
- hipotensión leve (ligera disminución de la presión arterial con sensación de mareo al levantarse)
- náusea
puede ser un signo precoz de hipersensibilidad y reacción anafiláctica.
Si se produce una reacción alérgica o anafiláctica, la inyección o perfusión se debe interrumpir y consultar a su médico inmediatamente.
Reacciones de hipersensibilidad
Durante los estudios clínicos realizados, ningún paciente desarrolló títulos de anticuerpos clínicamente importantes frente a las pequeñas cantidades de proteína de hámster y ratón presentes en el preparado. Existe la posibilidad de reacción alérgica a las sustancias contenidas en este medicamento, como por ejemplo, a las pequeñas cantidades de proteína de ratón y hámster, en pacientes con cierta predisposición. Su médico considerará realizarle algunas pruebas para controlar el desarrollo de inhibidores.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
 5. Conservación de KOGENATE Bayer
5. Conservación de KOGENATE Bayer
Mantener este medicamento fuera de la vista y del alcance de los niños.
Conservar en nevera (entre 2℃ y 8℃). No congelar. Conservar el vial y la jeringa precargada en el embalaje exterior para protegerlos de la luz.
Dentro de la fecha de caducidad indicada en la etiqueta, el medicamento envasado en su embalaje exterior puede conservarse a temperatura ambiente (inferior a 25℃) durante un periodo máximo de 12 meses. En este caso, el medicamento caduca al finalizar el periodo de 12 meses o en la fecha de caducidad indicada en el vial del medicamento, según cuál sea antes. Debe anotar la nueva fecha de caducidad en el embalaje exterior.
No refrigerar la solución después de su reconstitución. La solución reconstituida se debe utilizar en un plazo máximo de 3 horas. Utilizar el contenido una sola vez. Desechar la solución no utilizada.
No utilice este medicamento después de la fecha de caducidad que aparece en las etiquetas y las cajas. La fecha de caducidad es el último día del mes que se indica.
No utilice este medicamento si observa partículas o si la solución está turbia.
Los medicamentos nose deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma ayudará a proteger el medio ambiente.
 6. Contenido del envase e información adicional
6. Contenido del envase e información adicional
Composición de KOGENATE Bayer
Polvo
El principio activo es el factor VIII de la coagulación humano (octocog alfa) producido por tecnología de ADN recombinante. Cada vial de KOGENATE Bayer contiene 250, 500, 1000, 2000 ó 3000 UI de octocog alfa.
Los demás componentes son glicina, cloruro de sodio, cloruro de calcio, histidina, polisorbato 80 y sacarosa (ver el final de la sección 2).
Disolvente
Agua para preparaciones inyectables.
Aspecto del producto y contenido del envase
KOGENATE Bayer se presenta en forma de polvo y disolvente para solución inyectable; se presenta en forma de polvo o polvo compacto, de color blanco a ligeramente amarillo. La jeringa precargada contiene agua para preparaciones inyectables para reconstituir el contenido del vial. Después de la reconstitución la solución es transparente. Los dispositivos necesarios para la reconstitución y administración se proporcionan en cada envase de este medicamento.
Cada envase de KOGENATE Bayer contiene un vial con sistema de transferencia Bio-Set y una jeringa precargada con émbolo independiente, así como un equipo para punción venosa (para inyección intravenosa), dos gasas impregnadas en alcohol, dos gasas estériles secas y dos tiras adhesivas.
Titular de la autorización de comercialización
Bayer AG
51368 Leverkusen
Alemania
Responsable de la fabricación
Bayer HealthCare Manufacturing S.r.l.
Via delle Groane 126
20024 Garbagnate Milanese (MI)
Italia
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
| België/Belgique/Belgien Bayer SA-NV Tél/Tel: +32-(0)2-535 63 11 | Lietuva UAB Bayer Tel. +37 05 23 36 868 |
| България Байер България ЕООД Tел.: 359 02 81 401 01 | Luxembourg/Luxemburg Bayer SA-NV Tél/Tel: +32-(0)2-535 63 11 |
| Česká republika Bayer s.r.o. Tel: +420 266 101 111 | Magyarország Bayer Hungária KFT Tel:+36 14 87-41 00 |
| Danmark Bayer A/S Tlf: +45 45 23 50 00 | Malta Alfred Gera and Sons Ltd. Tel: +35 621 44 62 05 |
| Deutschland Bayer Vital GmbH Tel: +49 (0)214-30 513 48 | Nederland Bayer B.V. Tel: +31-(0)297-28 06 66 |
| Eesti Bayer OÜ Tel: +372 655 8565 | Norge Bayer AS Tlf: +47 23 13 05 00 |
| Ελλάδα Bayer Ελλάς ΑΒΕΕ Τηλ: +30-210-61 87 500 | Österreich Bayer Austria Ges.m.b.H. Tel: +43-(0)1-711 46-0 |
| España Bayer Hispania S.L. Tel: +34-93-495 65 00 | Polska Bayer Sp. z o.o. Tel: +48 22 572 35 00 |
| France Bayer HealthCare Tél (N° vert): +33-(0)800 87 54 54 | Portugal Bayer Portugal, Lda. Tel: +351 21 416 42 00 |
| Hrvatska Bayer d.o.o. Tel: +385-(0)1-6599 900 | România SC Bayer SRL Tel: +40 21 529 59 00 |
| Ireland Bayer Limited Tel: +353 1 2999313 | Slovenija Bayer d. o. o. Tel: +386 (0)1 58 14 400 |
| Ísland Icepharma hf. Sími: +354 540 8000 | Slovenská republika Bayer spol. s r.o. Tel. +421 2 59 21 31 11 |
| Italia Bayer S.p.A. Tel: +39 02 397 81 | Suomi/Finland Bayer Oy Puh/Tel: +358-20 785 21 |
| Κύπρος NOVAGEM Limited Tηλ: +357 22 48 38 58 | Sverige Bayer AB Tel: +46 (0) 8 580 223 00 |
| Latvija SIA Bayer Tel: +371 67 84 55 63 | United Kingdom Bayer plc Tel: +44-(0)118 206 3000 |
Fecha de la última revisión de este prospecto: {MM/AAAA}
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu
Instrucciones detalladas de reconstitución y administración de KOGENATE Bayer utilizando el vial con tapa de reconstitución (Sistema Bio-Set):
| Lávese cuidadosamente las manos con jabón y agua templada. La solución se debe preparar sobre una superficie limpia y seca. | |
| Caliente el vial sin perforar y la jeringa precargada con sus manos hasta que estén a la misma temperatura. El material no debe superar la temperatura corporal (no pasar de 37 ℃). | |
| Retire la cápsula protectora del vial que contiene el polvo moviéndola suavemente de un lado al otro, al tiempo que tira de ella hacia arriba. Retire el tapón unido a la cápsula blanca de la jeringa (A). |  |
| Enrosque con suavidad la jeringa en el vial del polvo (B). | 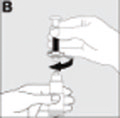 |
| Coloque el vial sobre una superficie rígida y antideslizante, y sujételo firmemente con una mano. Seguidamente, con sus dedos pulgar e índice, presione fuertemente la placa de sujeción del extremo de la jeringa (C) hasta tocar el borde superior del Bio-Set. | 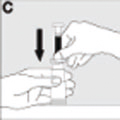 |
| Esto confirma que el sistema está activado (D). |  |
| Conecte el émbolo a la jeringa haciéndolo girar dentro del tapón de goma (E). | 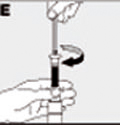 |
| Inyecte el disolvente en el vial que contiene el polvo empujando lentamente el émbolo de la jeringa (F). |  |
| Disuelva el polvo girando suavemente el vial (G). No agite el vial! Antes de utilizar, compruebe que el polvo se ha disuelto completamente. Inspeccione visualmente la presencia de partículas o un cambio de color antes de la administración. No utilice soluciones turbias o que contengan partículas visibles. |  |
| Invierta el conjunto formado por el vial y la jeringa y transfiera la solución a la jeringa tirando lenta y suavemente del émbolo (H). Compruebe que todo el contenido del vial ha pasado a la jeringa. Mantenga la jeringa en posición vertical y presione el émbolo hasta que no quede aire en el interior de la jeringa. |  |
| Aplique un torniquete. Determine el punto de inyección y desinfecte la piel con una gasa impregnada en alcohol y prepare la zona de inyección asépticamente siguiendo las instrucciones de su médico. Practique la punción venosa y fije el equipo de punción con una tira adhesiva. | |
| Desenrosque la jeringa para desconectarla del vial (I). | 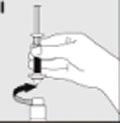 |
| Acople la jeringa al equipo de punción venosa, enroscándola en la dirección de las agujas del reloj y asegúrese de que no entra sangre en la jeringa (J). |  |
| Retire el torniquete. | |
| Inyecte la solución en la vena durante 2 a 5 minutos, vigilando en todo momento la posición de la aguja. La velocidad de administración se basará en el grado de bienestar del paciente, pero no debe ser mayor de 2 ml/min. | |
| Si se necesita administrar una dosis adicional, retire la jeringa vacía haciéndola girar al contrario de las agujas del reloj. Reconstituya la cantidad deseada de producto, repitiendo los pasos 2 – 9, utilizando una nueva jeringa y conectándola al equipo de punción venosa. | |
| Si no se precisan más dosis, retire el equipo de punción venosa y la jeringa. Aplique una gasa durante unos 2 minutos sobre el punto de inyección, manteniendo el brazo extendido. Finalmente, presione sobre el punto de inyección y considere si es necesario colocar una tira adhesiva. | |

