Informe de Posicionamiento Terapéutico de pazopanib (Votrient®) en sarcoma de tejidos blandos avanzado
INFORME DE POSICIONAMIENTO TERAPÉUTICO PT-PAZOPANIB-SARCOMA/V2/11032015
Informe de Posicionamiento Terapéutico de pazopanib (Votrient®) en sarcoma de tejidos blandos avanzado
Fecha de publicación: 11 de marzo de 2015
Pazopanib (Votrient®) es un inhibidor de quinasas con actividad preferentemente antiangiogénica autorizado en la Unión Europea (UE) para el tratamiento del carcinoma renal avanzado tanto en primera línea como tras progresión a otras citoquinas. En agosto de 2012, la Agencia Europea del Medicamento (EMA) ha aceptado la ampliación de su indicación para el tratamiento de pacientes adultos con determinados subtipos de Sarcoma de Tejidos Blandos (STB) avanzado que hayan recibido previamente tratamiento con quimioterapia para tratar su enfermedad metastásica o en aquellos pacientes adultos cuya enfermedad ha progresado en los 12 meses siguientes tras recibir tratamiento neo-adyuvante y/o adyuvante (1). El siguiente Informe de Posicionamiento Terapéutico se refiere a esta segunda indicación.
Los STB constituyen menos del 1% de los cánceres en adultos, aunque su frecuencia es notablemente mayor en niños y adolescentes. Constituye un grupo de más de cien variedades histológicas cuyo denominador común radica en originarse a partir de tejidos de origen mesenquimal y/o de sus células precursoras (2).
El desconocimiento de las bases moleculares de los subtipos histológicos y la escasez de medicamentos eficaces para el tratamiento de los STB han conducido a la utilización de estrategias terapeúticas estandarizadas, independientemente de la realidad biológica de los mismos. Sin embargo, durante la última década, se ha avanzado de forma considerable en el conocimiento molecular de los STB (2). En algunos casos, este conocimiento ha dado lugar a tratamientos muy específicos, como es el caso de imatinib o sunitinb para el tratamiento de los GIST.
La selección del tratamiento farmacológico, depende de los diferentes tipos histológicos que conforman los STB.
El tratamiento estándar de los STB se basa en la cirugía con márgenes amplios. En el caso de las extremidades y, en menor medida, de la pared torácica, la cirugía conservadora combinada con radioterapia adyuvante es la práctica habitual. La evidencia sobre la eficacia de la quimioterapia adyuvante es limitada, pero su recomendación, basada en doxorubicina e ifosfamida a dosis altas, aparece en la totalidad de guías de práctica clínica, aunque con diferencias entre unas y otras respecto a la selección de casos (3).
La heterogeneidad de los STB se pone particularmente de manifiesto en el ámbito de la enfermedad avanzada. Conviven bajo la misma denominación, sarcomas que pueden ser curados en fase metastásica mediante esquemas intensivos y muy bien definidos de quimioterapia (como el sarcoma de Ewing o el rabdomiosarcoma), con otros que resultan virtualmente resistentes a cualquier combinación, como el liposarcoma bien diferenciado o los angiosarcomas radioinducidos.
Actualmente la doxorubicina se considera la base del tratamiento de primera línea de los sarcomas avanzados y el comparador de elección para los ensayos clínicos. No obstante, es cada vez más común que las guías incluyan entre las opciones de primera línea otras posibilidades (3), generalmente basadas en ensayos fase II y a menudo con medicamentos sin indicación aprobada por la Food and Drug Administration (FDA) o la EMA. Entre ellos, se encuentran la trabectedina para el liposarcoma mixoide, los taxanos en el caso de los sarcomas de la vaina nerviosa periférica o el leiomiosarcoma uterino, el imatinib para el cordoma o el tumor desmoide, sunitinib para el sarcoma alveolar de partes blandas, denosumab para el tumor de células gigantes del hueso o sirolimus en los pacientes con PEComas.
Las opciones genéricas de tratamiento de segunda línea comprenden ifosfamida, dacarbacina, combinaciones de taxanos y de gemcitabina, doxorubicina liposomal, epirubicina o trabectedina (3). No existe, en realidad, evidencia sólida para anteponer alguna de estas opciones sobre el resto. La ifosfamida es el medicamento usado tradicionalmente en segunda línea, aunque se emplea a menudo en primera línea, combinada con la doxorubicina. Otras opciones en segunda línea son: la combinación de gemcitabina con taxanos o dacarbazina, que son las de aplicación más común en nuestro país, al igual que la trabectedina, si bien se debate la actividad de esta última en otras variedades histológicas distintas al liposarcoma mixoide y leiomiosarcoma (los llamados “sarcomas L”). La aprobación en la UE y en España de la trabectedina se limita a los pacientes pretratados con doxorubicina e ifosfamida o inadecuados para el tratamiento. Aunque no restringe su empleo a ninguna variedad, la ficha técnica se hace eco de su mayor grado de evidencia en los sarcomas L.
PAZOPANIB (VOTRIENT®)
Pazopanib (Votrient®) ha sido autorizado para el tratamiento de pacientes adultos con determinados subtipos de STB avanzado que hayan recibido previamente tratamiento con quimioterapia para tratar su enfermedad metastásica o en aquellos pacientes adultos cuya enfermedad ha progresado en los 12 meses siguientes tras recibir tratamiento neo-adyuvante y/o adyuvante (4).
Farmacología
Pazopanib es un inhibidor multiquinasa con biodisponibilidad oral. Actúa sobre las tres variedades del receptor del factor de crecimiento vásculo-endotelial (VEGFR-1, VEGFR-2 y VEGFR-3), así como sobre el receptor del factor de crecimiento plaquetario alfa (PDGFα). Además de esta paninhibición antiangiogénica, también actúa bloqueando los receptores de stem-cell factor (cKit) y el transmembranario CSF1 de tirosín-quinasa (c-Fms), así como la quinasa de células T inducible por interleucina 2 (ITK) y la proteín- tirosínquinasa específica de leucocitos (Lck).
Se trata, pues, de un antiangiogénico multifuncional, no selectivo y de gran potencia biológica. La neoangiogénesis tumoral es un proceso oncogénico básico y una diana terapéutica en la que se basan tratamientos oncológicos firmemente establecidos en la práctica cotidiana, como sucede en los casos del cáncer colorectal, pancreático, mamario o renal. La familia de los receptores para VEGF constituye la principal vía angiogénica en el cáncer humano y su sobreexpresión se observa en la casi totalidad de variedades de STB en los que se ha investigado. Además, se asocia con criterios de agresividad biológica y de progresión como el grado histológico, la supervivencia libre de progresión y la supervivencia global. VEGFR es, pues, una diana terapéutica obvia para la investigación clínica en sarcomas. Aunque en menor grado, el papel de PDGFR también está bien documentado en varias clases de STB. Pazopanib resulta ser la primera molécula antiangiogénica que alcanza aprobación en Europa y USA para el tratamiento de los STB.
El estudio farmacológico se basa en un estudio farmacocinético in vitro, otro farmacodinámico in vivo, un estudio específico de toxicidad con dosis repetidas en animales de laboratorio y otros tres semejantes enfocados a la toxicidad reproductiva. Todo ello apoya la dosis recomendada de 800 mg en dosis única diaria. El ensayo fase II VEG2002 sirvió de plataforma para el estudio farmacocinético y farmacodinámico (5).
Eficacia
El primer ensayo clínico que analiza la eficacia de pazopanib en STB es el ensayo fase II VEG20002, no aleatorizado, abierto y de rama única (6). En función de éste, se diseñó el ensayo clínico pivotal fase III VEG110727 (5,7), cuyos resultados positivos condujeron a la solicitud de ampliación de indicación a la EMA. Se trata de un ensayo aleatorizado 2:1 doble ciego, controlado con placebo, que analizó como variable principal la supervivencia libre de progresión (SLP) y como variables secundarias la supervivencia global (SG), la tasa de respuesta y la duración de la respuesta. El reclutamiento fue más rápido de lo esperado, lo que permitió aumentar el tamaño muestral previsto hasta 369 sujetos, incrementando así la potencia del estudio hasta un 95% para detectar un HR de 0,63 respecto a la SLP y hasta un 90% para detectar un HR mínimo de 0,67 para la SG.
Se incluyeron pacientes con STB metastásico con progresión tras un máximo de cuatro líneas previas de quimioterapia para la enfermedad avanzada, incluyendo obligatoriamente las antraciclinas. Debían haber transcurrido un máximo de 6 meses desde la última quimioterapia para enfermedad avanzada y 12 meses desde la última quimioterapia adyuvante. Se excluyeron los pacientes con estado funcional mayor o igual a 2, pacientes con GIST (debido a la existencia de alternativas terapéuticas), liposarcomas (en este caso a causa de la falta de eficacia observada en el ensayo fase II) y otras histologías: rabdomiosarcoma, sarcomas esqueléticos (de estirpe ósea o condral), sarcomas de Ewing/PNET, dermatofibrosarcoma protuberans, sarcoma inflamatorio miofibrostático, mesotelioma maligno y tumores mesodérmicos de útero. La estratificación se realizó teniendo en cuenta el estado funcional y el número de líneas de quimioterapia recibidas. La evaluación de la respuesta fue independiente, centralizada y ciega.
En el momento del análisis, un 96% de los sujetos aleatorizados a placebo habían abandonado el estudio y 63% habían muerto, debido a la progresión de la enfermedad, frente al 68% y 56%, respectivamente, de los asignados al pazopanib. Las características de los pacientes se ajustaron a las encontradas en la práctica clínica: edad media de 55 años, metástasis pulmonares en la mayoría de ellos, una tercera parte con metástasis en más de tres lugares anatómicos y con progresión de enfermedad tras unos cuatro meses después de la última quimioterapia. El tipo histológico mayoritario era leiomiosarcoma (n= 158), seguido de sarcoma sinovial (n= 38), pleomórfico (n= 31) o indiferenciado (n= 20). Los tratamientos previos más comunes incluían doxorubicina (98%), ifosfamida (70%), docetaxel (28%), gemcitabina (34%), trabectedina (16%) y dacarbazina (15%). El único tratamiento dirigido incluido entre los recibidos previamente eran los inhibidores de mTor, pero con un uso testimonial (4%).
En el análisis por intención de tratar, según la revisión radiológica independiente, la rama de tratamiento con pazopanib se benefició de modo significativo en la SLP. En la población total, la mediana de SLP de pazopanib comparado con placebo fue de 20 vs 7 semanas (HR 0,35 [IC: 0,26; 0,48]) (ver gráfica 1). En el análisis por subrupos, en los pacientes con leiomiosarcoma y otros STB, la SLP aumentó respecto a la población total: 20,1 vs 8,1 semanas (HR 0,37) para leiomiosarcoma y 20,1 vs 4,3 semanas (HR 0,39) para otros STB, disminuyendo en los pacientes con sarcoma sinovial,
Se realizó un análisis por subgrupos de importancia clínica (edad, estado funcional, número de líneas de quimioterapia recibidas previamente, histología y grado), con el resultado de que la ventaja de pazopanib en términos de SLP se mantenía en todos ellos.
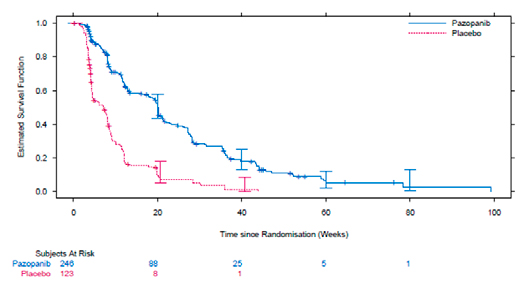
Gráfica 1: Supervivencia libre de progresión estimada mediante la curva de Kaplan-Meier
Sin embargo, no se observan diferencias estadísticamente significativas en la SG (gráfica 2). La mediana estimada de SG fue de 12,6 meses en la rama de pazopanib y 10,7 meses en la rama de placebo. El hazard ratio ajustado fue de 0,87 (p=0,256).
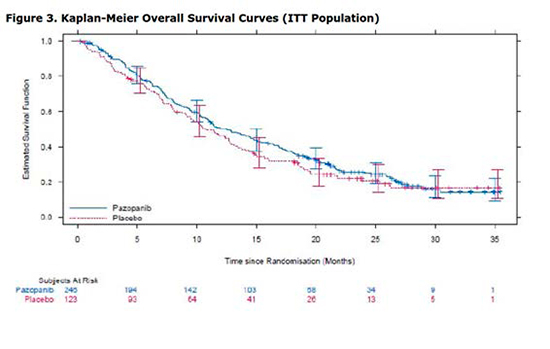
Gráfica 2: Supervivencia global estimada mediante la curva de Kaplan- Meier
Un 72% de los sujetos de placebo recibió otro tratamiento tras la progresión, mientras que esto solo sucedió en un 54% de los casos tras progresión a pazopanib.
La diferencia en la tasa de respuesta global entre las dos ramas fue del 4% (IC 95% 2,3-7,91) según la evaluación independiente. La mediana de duración de la respuesta fue de 38,9 semanas. Como en el caso de otros tratamientos inhibidores de quinasas, la tasa de respuesta en términos de volumen resultó muy baja (4% de respuestas parciales con pazopanib; ninguna en el caso de placebo), poniendo de manifiesto la importancia de la estabilización de la enfermedad en esta clase de tratamientos (54% frente al 27% del placebo).
Con relación a las variables exploratorias de calidad de vida, se llevaron a cabo la recogida de datos según los cuestionarios de 8ª semana (47%-28% vs 63%-55% de los pacientes cumplimentaron los cuestionarios en la semana 8ª y 12ª para placebo y pazopanib respectivamente) no mostró diferencias estadísticamente significativas entre los grupos de tratamiento, si bien, hubo diferencias notables en diarrea, pérdida de apetito, nauseas, vómitos y fatiga a favor del grupo placebo. Los datos del cuestionario EQ-5D no mostraron diferencias significativas.
Seguridad
En el ensayo pivotal, el 99% de los pacientes en el brazo de pazopanib y el 89% del brazo placebo comunicaron efectos adversos (EAs) en la práctica totalidad de individuos experimentales (99%), pero también en el 89% de los que consumieron el placebo, reflejando cuántos de los EAs debieron deberse, en realidad, a los síntomas de la enfermedad.
Los EAs más comunes en los pacientes tratados con pazopanib fueron fatiga (65%), diarrea (59%), náuseas (56%), disminución de peso (48%), hipertensión (42%), disminución del apetito (40%) y cambios de color del cabello (39%). En el grupo de placebo los más comunes fueron fatiga (48%), náuseas (22%), dolor relacionado con el tumor (21%), dolor musculoesquelético (20%), disminución del apetito (19%), disnea (17%), estreñimiento (17%) y diarrea (15%). En comparación, los síntomas directamente relacionados con el tumor y algunos síntomas constitutivos se produjeron con una frecuencia similar en el grupo de pazopanib en comparación con el grupo placebo (dolor relacionado con el tumor 29%, dolor musculoesquelético 23%, disnea 20%, estreñimiento 14%).
En cuanto a su gravedad, 49% de los EAs acaecidos en la rama de pazopanib alcanzaron el grado 3 y 10% el grado 4 (frente al 19% y el 6% en la rama de placebo). Los más frecuentes fueron cansancio, dolor relacionado con el tumor, hipertensión, disminución del apetito, disnea y diarrea. Sólo hubo un caso dudoso de muerte relacionada con EAs severos en el grupo de pazopanib (fallo multiorgánico).
Algunos EAs se sometieron a un escrutinio particular por haberse relacionado previamente con pazopanib y considerarse potencialmente peligrosos: hepatotoxicidad, miocardiopatía, neumotórax y tromboembolismo venoso. Las alteraciones hepáticas fueron infrecuentes, exclusivamente bioquímicas y reversibles con la suspensión del tratamiento. Los casos de insuficiencia cardíaca mostraron un ligero incremento en la rama de pazopanib, pero todos ellos estaban relacionados con situaciones preexistentes (casi siempre tratamiento con antraciclinas) y pudieron ser manejados con medidas convencionales hasta la recuperación total o parcial. En la totalidad de los ensayos clínicos con pazopanib, se han comunicado 8 casos de neumotórax, que podrían ser debidos a la necrosis de metástasis pulmonares periféricas con afectación pleural y, por lo tanto, ligados a la respuesta. Todos los casos se pudieron solucionar con las medidas habituales para esta complicación. En cuanto al tromboembolismo venoso, un efecto adverso de clase ligado a los antiangiogénicos, el análisis identificó que todos los casos fatales estuvieron vinculados a la progresión de la enfermedad, pese a un ligero exceso de incidencia en la rama experimental (5% frente a 3%) (5).
Como medidas indirectas de seguridad, pero globales y vinculadas a la práctica clínica, las mediciones de calidad de vida, aunque peores en la rama de tratamiento, no alcanzaron la significación estadística. Por otra parte, la dosis diaria media de pazopanib (700 mg/día) se aproximó mucho a la teórica (800 mg/día), mientras que la tasa de retirada por decisión del paciente en la rama de tratamiento no superó el 5%.
DISCUSIÓN
El posicionamiento terapéutico de pazopanib en el ámbito de los STBs avanzados debe considerarse sin perder de vista la enfermedad de que se trata. No sólo es un diagnóstico raro, juvenil en muchos casos, y sujeto a escasas opciones terapéuticas reales; además, está atomizado en infinidad de subvariedades respecto a las cuales el conocimiento biológico crece y se modifica casi de mes en mes. Esta circunstancia propicia una revolución del paradigma de tratamiento en el que los profesionales se alejan cada vez más de las quimioterapias “de amplio espectro” y procuran ajustar sus elecciones terapéuticas al sarcoma particular de que se trate, en base a la racionalidad empírica. Esta aspiración choca en la práctica con dificultades en el diseño de los ensayos clínicos que, o por demasiado clásicos sólo perpetúan el status quo o, por demasiado innovadores, se granjean dificultades regulatorias.
Pazopanib se apoya en la base biológica de la neoangiogénesis tumoral y el papel de VEGFR, que ha resultado muy fructífera en otros diagnósticos tumorales, pero que permanecía sin representación en los STB.
El fundamento empírico descansa en un único ensayo clínico fase III (VEG110727) frente a placebo, con un tamaño muestral (n= 369) aceptable en el terreno de los STBs. El diseño es adecuado en aspectos clave como el equilibrio entre la inclusión de una variedad de sarcomas, la exclusión selectiva y racional de algunos subtipos (como los liposarcomas), la estratificación según criterios clínicamente relevantes, el reclutamiento de una población con características semejantes a las observadas en la práctica clínica o el análisis específico y detallado de la toxicidad.
La SLP se triplicó en el grupo experimental, que dobló respecto a placebo el número de sujetos que obtuvieron una estabilización clínicamente útil, y ello en todos los subgrupos tanto histológicos como pronósticos. Estos resultados más que duplicaban el objetivo considerado como relevante a la hora de calcular el tamaño muestral.
Si bien no se permitió el tratamiento con pazopanib, a un gran número de pacientes se les ofreció la posibilidad de recibir nuevas líneas de tratamiento tras la progresión, siendo esto más frecuente en la rama placebo. Por este motivo, el hecho de que las diferencias en SG fueran menores a las esperadas pudo deberse a una dilución del efecto observado atribuible a las líneas de tratamiento subsiguientes a la progresión, aunque también podría deberse a la existencia de un fenómeno de rebote al descontinuar el tratamiento con pazopanib.
Por último, la toxicidad era la esperada y conocida en un medicamento ya empleado en otras indicaciones. Las medidas clínicamente significativas de toxicidad (baja tasa de abandonos considerando la línea de tratamiento y ajuste entre la dosis teórica y la real) hablan en favor de la posibilidad de uso prolongado del medicamento.
No existe comparación directa con las escasas alternativas para el tratamiento de segunda línea de los STBs, ni es previsible que existan en el futuro inmediato, dadas las peculiaridades de infrecuencia y variedad del diagnóstico. La comparación indirecta resulta especialmente inadecuada en este contexto, dadas las diferencias sustanciales entre los ensayos clínicos que fundamentan los distintos tratamientos y que llegan al punto de la inclusión de variedades histológicas en unos que están excluidas en otros.
Existen alternativas para el tratamiento de segunda y sucesivas líneas en los STBs. La razón para recomendar sistemáticamente la ifosfamida tras el uso de las antraciclinas es tan solo histórica, dado que se trata de la única alternativa activa disponible durante las dos pasadas décadas. Se trata de un medicamento tóxico, particularmente histológica concreta y el equilibrio previsible entre eficacia y toxicidad.
La utilización de gemcitabina con dacarbazina o docetaxel se basa en ensayos clínicos independientes de pequeño tamaño (8, 9) y si bien su uso no está recogido por las agencias reguladoras, la calidad de los datos y su recomendación en las guías clínicas (10) hacen necesaria su consideración como un comparador para el posicionamiento. Así y a pesar de las limitaciones de la comparación, el tratamiento de gemcitabina en combinación parece ofrecer resultados similares en cuanto a SLP y SG que pazopanib. En cuanto a seguridad, si bien el perfil de pazopanib y el de gemcitabina en combinación son diferentes, existen incertidumbres en cuanto a la tolerabilidad comparada entre estas alternativas.
Otros medicamentos, como el imatinib y el sunitinib, han mostrado eficacia en unos tipos de sarcomas muy específicos como son los sarcomas que afectan al estroma gastrointestinal y el dermatofibrosarcoma.
Trabectedina es el único medicamento aprobado en la UE para el tratamiento de segunda línea de los STB antes de la aprobación de pazopanib. El registro se basó en un ensayo clínico que comparaba dos pautas del mismo medicamento (infusión de 3 horas vs infusión de 24 horas) en pacientes con liposarcoma y leiomiosarcoma y otras variedades que progresaron a doxorubicina e ifosfamida (11). La rama de 24 horas no obtuvo ventaja de supervivencia global, pero prolongó el tiempo de progresión desde 2,3 hasta 3,7 meses. La mediana de supervivencia alcanzaba 13,9 meses y el 60% de los pacientes permanecieron vivos tras un año de tratamiento. Las circunstancias excepcionales de la aprobación tuvieron en cuenta la ausencia de agentes aprobados para la indicación propuesta y resaltaba el aparente mayor beneficio clínico en los sarcomas L (leiomiosarcoma y liposarcoma). El uso clínico y las investigaciones posteriores han puesto de manifiesto que la actividad de trabectedina es muy elevada en determinados subtipos de STB, particularmente el liposarcoma mixoide (12). Por otro lado, el posicionamiento de trabectedina frente a pazopanib en los liposarcomas no es discutible, puesto que sólo el primer medicamento está indicado en esta histología.
Una comparación entre la eficacia de trabectedina y pazopanib en otras histologías, resultaría de interés, particularmente en el caso de los leiomiosarcomas, dada su relativa frecuencia y la indicación de ambos medicamentos para esta variedad de sarcomas. No obstante, las únicas comparaciones posibles son indirectas, basadas en grupos pequeños y/o en poblaciones no equiparables, por lo que existen incertidumbres a la hora de resaltar posibles diferencias en los perfiles de seguridad de ambos medicamentos, aparte de las ventajas de un tratamieno oral frente a otro intravenoso. Así, la duración de la exposición al medicamento fue de 8,4 semanas en el caso de trabectedina frente a 19,3 en el caso de pazopanib. Las reducciones de dosis por causa de toxicidad fueron necesarias en el 33% de los pacientes tratados con la pauta de infusión en 24 horas, y en el 32% de sujetos asignados a la rama experimental en el ensayo pivotal de pazopanib. Pero, mientras que en el caso de trabectedina se realizaron reducciones de segundo (22%) y tercer nivel (4%), en el de pazopanib todas ellas fueron de primer escalón y mínimas (la dosis mediana diaria fue de 794,21 mg sobre un máximo teórico de 800 mg). Por otro lado, la suspensión de tratamiento debida a toxicidad fue del 20% en el caso de pazopanib, pero solo del 8% en los pacientes tratados con trabectedina 24h, reflejando, seguramente, el mayor nivel de reducción de dosis y una elevada incidencia de retrasos en los ciclos (56%).
Así pues, no es posible realizar una recomendación basada en la evidencia sobre la preferencia de trabectedina o pazopanib para el tratamiento de segunda línea de los STBs, aparte de los liposarcomas, presentándose ambos medicamentos como opciones alternativas y aceptables. No obstante, podrían mencionarse algunas diferencias: la aprobación de pazopanib no está limitada por el tipo de agente o número de líneas empleado, y presenta una administración oral.
CONCLUSIÓN
Pazopanib es una alternativa válida para el tratamiento de enfermos con STB avanzado que hayan progresado al menos a una línea de quimioterapia previa. Se excluyen los sarcomas adipocíticos, el rabdomiosarcoma, los sarcomas esqueléticos (de estirpe ósea o condral), el GIST y los sarcomas de Ewing/PNET.
Pazopanib se presenta como una alternativa terapéutica a gemcitabina en combinación, si bien se dispone de una mayor evidencia de datos con pazopanib. En el tratamiento de los leiomiosarcomas en segunda línea, pazopanib sería una alternativa terapéutica a trabectedina. Asimismo, pazopanib puede constituir una opción terapéutica en tercera línea, tras la administración de las anteriores alternativas.
REFERENCIAS
1. Fletcher, C. (2002). World Health Organization Classification of Tumors. Pathology and Genetics of Tumors of Soft Tissue and Bone. Lyon: IARC Press.
2. Blay JY, Sleijfer S, Schöffski P, et al. International expert opinion on patient-tailored management of soft tissue sarcomas. Eur J Cancer. 2014 Mar;50(4):679-689
3. Sharma S, Takyar S, Manson SC, et al. Efficacy and safety of pharmacological interventions in second- or later-line treatment of patients with advanced soft tissue sarcoma: a systematic review. BMC Cancer. 2013 Aug 13;13:385
4. Ficha Técnica de Votrient disponible en : http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_- _Product_Information/human/001141/WC500094272.pdf acceso noviembre 2014)
5. EPAR de Votrient disponible en: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/001141/WC500094275.pdf (acceso noviembre 2014)
6. Sleijfer S, Ray-Coquard I, Papai Z, et al. Pazopanib, a multikinase angiogenesis inhibitor, in patients with relapsed or refractory advanced soft tissue sarcoma: a phase II study from the European organisation for research and treatment of cancer-soft tissue and bone sarcoma group (EORTC study 62043). J Clin Oncol. 2009;27(19):3126-3132.
7. van Der Graaf WTA, Blay JY, Chawla SP, et al. Pazopanib in metastatic soft tissue sarcoma (PALETTE, EORTC 62072): a randomized, double-blind, placebo controlled phase 3 trial.. Lancet. 2012;379(9829):1879-86
8. Maki RG, Wathen JK, Patel N, et al. Randomized phase II study of gemcitabine and docetaxel compared with gemcitabine alone in patients with metastatic soft-tissue sarcomas. J Clin Oncol 2007; 25: 2755-63
9. García del Muro et al. Estudio fase II aleatorizado para comparar gemcitabina más dacarbazina con dacarbazina en monoterapia en pacientes con sarcoma de tejidos blandos tratado previamente: estudio del Grupo Español de Investigación en Sarcomas. J Clin Oncol.2011; 29: 2528-2533
10. The ESMO/European Sarcoma Network Working Group. Soft tissue and visceral sarcomas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 25 (Supplement 3): iii102–iii112, 2014
11. Demetri GD1, Chawla SP, von Mehren M,et al. Efficacy and safety of trabectedin in patients with advanced or metastatic liposarcoma or leiomyosarcoma after failure of prior anthracyclines and ifosfamide: results of a randomized phase II study of two different schedules.J Clin Oncol. 2009;27(25):4188-96
12. Grosso F, Jones RL, Demetri GD, et al. Efficacy of trabectedin (ecteinascidin-743) in advanced pretreated myxoid liposarcomas: a retrospective study. Lancet Oncol. 2007;8:595–602
GRUPO DE EXPERTOS
(por orden alfabético)
Agencia Española de Medicamentos y Productos Sanitarios
Ricardo Cubedo
Servicio de Oncología. Hospital Universitario Puerta de Hierro, Madrid
Dirección General de Farmacia y Productos Sanitarios. Conselleria de Sanitat. Valencia.
Todos los expertos han realizado una declaración de conflictos de interés.
El Laboratorio Titular, la Sociedad Española de Oncología Médica, la Sociedad Española de Farmacología Clínica, la Sociedad Española de Farmacia Hospitalaria y el Grupo Español de Pacientes con Cáncer han tenido oportunidad de enviar comentarios al documento, si bien el texto final es el adoptado por el Grupo de Coordinación del Posicionamiento Terapéutico.
Este protocolo fármaco-clínico ha sido elaborado a petición de la Comisión Interministerial de Precios.
Fuente: Agencia Española de Medicamentos y Productos Sanitarios.
