Última Información
- Principios Activos
- Alertas
- Problemas Suministro
- Actualización monografías Principios Activos
- Noticias

PRODUCTOS SANITARIOS, COSMÉTICOS Y OTROS.
Cese de utilización y retirada del mercado del lote R1033A de la solución oftálmica Optiben Ojos Secos 10ml
Fecha de publicación: 23 de diciembre de 2022 Categoría: productos sanitarios Referencia: PS, 40/2022 · La AEMPS informa del cese de utilización y de la retirada del mercado del lote R1033A de la solución oftálmica Optiben Ojos Secos 10ml fabricada por Avizor SA, España · El envase del lote R1033A podría contener un producto diferente utilizado para los exámenes de fondo de ojo cuya aplicación puede provocar reacciones alérgicas, visión borrosa, irritación, etc · La Agencia establece una serie de recomendaciones de cómo actuar para distribuidores y pacientes 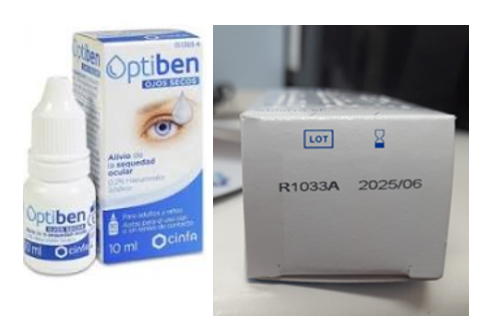 Figura 1. Posición del número de lote en el envase de Optiben Ojos Secos 10 ml.  Figura 2. Imagen del envase de Methocel que se podría encontrar erróneamente en el envase del lote afectado de Optiben Ojos Secos. INFORMACIÓN PARA DISTRIBUIDORES Y ESTABLECIMIENTOS DE VENTA COMO ÓPTICAS Y FARMACIAS Y PARA PACIENTES La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ha tenido conocimiento, a través del fabricante Avizor SA, España, del cese de utilización y de la retirada del mercado de la solución oftálmica Optiben Ojos Secos 10ml con número de lote R1033A. Optiben Ojos Secos es una solución oftálmica para la humectación y lubricación del ojo como el alivio de la sensación de sequedad y las irritaciones oculares ocasionadas por las condiciones ambientales, el cansancio, el trabajo prolongado frente a dispositivos digitales o el uso de lentes de contacto. De acuerdo con la información facilitada por la empresa, se ha detectado que el envase del lote afectado de Optiben Ojos Secos (lote R1033A) puede contener un producto diferente, en concreto Methocel Alemania 3x10gr número de lote R1086A. Este producto se utiliza como solución de contacto entre el ojo y la lente de uso diagnóstico en el examen de fondo de ojo con lámpara de hendidura, en gonioscopía o determinados tratamientos oculares. El uso inadvertido de Methocel en lugar de Optiben podría provocar una reacción alérgica en el paciente, además de visión borrosa transitoria debido a la diferente viscosidad de ambos productos, entre otros tipos de efectos adversos como enrojecimiento, irritación, escozor, etc. Optiben Ojos Secos se distribuye en España a través de la empresa Laboratorios Cinfa (Travesía de Roncesvalles, 31699 Polígono de Olloki, Navarra). Situación actual en España La empresa está enviando, a través de sus distribuidores en España, una nota de aviso a los pacientes, establecimientos de venta y distribución, que disponen del producto afectado, para informarles del problema identificado y de las acciones a seguir para la retirada del producto. Productos afectados Optiben ojos secos 10ml número de lote R1033A (figura 1 y 2). INFORMACIÓN PARA DISTRIBUIDORES Y ESTABLECIMIENTOS DE VENTA COMO ÓPTICAS Y FARMACIAS · Examine de inmediato su inventario y si dispone de unidades de Optiben Ojos Secos del lote afectado, cese su distribución y venta, y siga las instrucciones de la nota de aviso de la empresa. · Si tiene conocimiento de algún incidente relacionado con el uso de estos productos, notifíquelo a través del portal de notificación NotificaPS. INFORMACIÓN PARA PACIENTES/CUIDADORES Si usted está utilizando algún envase de la solución oftálmica Optiben del lote indicado en la sección de “Productos afectados”: · Verifique el contenido del envase y en caso de ser Methocel Alemania 3x10gr número de lote R1086A, deje de utilizarlo y póngase en contacto con el establecimiento donde adquirió el producto para su devolución. · Informe a su profesional médico de cualquier posible efecto adverso asociado al uso del producto como visión borrosa transitoria o reacción alérgica o enrojecimiento, entre otros. · Puede notificar cualquier efecto adverso o incidente relacionado con el producto a través del portal de notificación NotificaPS. Datos de la empresa Laboratorios Cinfa. Travesía de Roncesvalles, 31699 Polígono de Olloki, Navarra. España Datos del fabricante Avizor SA Avenida de la Innovación 2, 28919, Leganés, Madrid, España
|
| Enlaces de Interés | ||||
|
|
|||
| Fuente: Agencia Española de Medicamentos y Productos Sanitarios |

