Última Información
- Principios Activos
- Alertas
- Problemas Suministro
- Actualización monografías Principios Activos
- Noticias

MEDICAMENTOS DE USO HUMANO: SEGURIDAD
Xeljanz (tofacitinib): nuevas precauciones de uso en pacientes mayores de 65 años
Fecha de publicación: 5 de julio de 2021 Categoría: medicamentos de uso humano, farmacovigilancia
Tofacitinib es un inhibidor de la Janus quinasa (JAK) que está indicado para el tratamiento de (consultar la ficha técnica de Xeljanz para información detallada):
El Comité para la Evaluación de Riesgos en Farmacovigilancia (PRAC) de la Agencia Europea de Medicamentos (EMA) ha evaluado los resultados preliminares del estudio ORAL Surveillance (A3921133) presentados tras su finalización1. El estudio A3921133 es un ensayo clínico aleatorizado, de no inferioridad, controlado con tratamiento activo, para evaluar la seguridad de tofacitinib con dos dosis (5 mg dos veces al día y 10 mg dos veces al día) frente a un inhibidor del factor de necrosis tumoral alfa (TNFi) en pacientes con artritis reumatoide de 50 años de edad o mayores que tuvieran al menos un factor de riesgo cardiovascular adicional2. El objetivo principal de este estudio fue evaluar la seguridad cardiovascular y de malignidad de tofacitinib en comparación con TNFi. Los resultados preliminares indican un incremento en la incidencia de eventos adversos cardiovasculares mayores (en particular, infarto agudo de miocardio no fatal) y de neoplasias malignas (excluyendo cáncer de piel no melanoma, CPNM) particularmente cáncer de pulmón, en los pacientes tratados con tofacitinib en las dos pautas de dosificación utilizadas en comparación con los tratados con un inhibidor del TNF-alfa. Previamente, en 2019, se introdujeron restricciones de uso en base a la evaluación de resultados intermedios de este estudio (ver nota de seguridad de la AEMPS MUH(FV) 18/2019).
Los resultados del estudio indican un aumento del riesgo de infarto de miocardio con desenlace no fatal en los pacientes tratados con tofacitinib 5 mg o con ambas dosis de tofacitinib en comparación con los tratados con TNFi [(HR (95%) tofacitinib 5 mg vs TNFi: 2,32 (1,02; 5,30) y HR (95%) ambas dosis de tofacitinib vs TNFi: 2,20 (1,02; 4,75)]. Los datos sobre este incremento de riesgo son mayores y más patentes en pacientes de 65 años de edad o mayores para todos los grupos de tratamiento frente a TNFi (ver los datos concretos en el anexo de esta nota informativa).
Estos resultados muestran un aumento de la tasa de incidencia de neoplasias malignas, en particular de cáncer de pulmón, en los pacientes tratados con tofacitinib en comparación con los tratados con inhibidores del TNF-alfa. También se observan tasas de incidencia mayores, aunque no estadísticamente significativas, para el desarrollo de linfoma, riesgo ya conocido e incluido en la ficha técnica del medicamento (ver los datos concretos en el anexo de esta nota informativa). Se han analizado los factores de riesgo de los pacientes que presentaron infarto de miocardio y neoplasia maligna:
En base a estos resultados se ha establecido que los pacientes mayores de 65 años que presenten factores de riesgo cardiovascular o para el desarrollo de neoplasias no deben recibir tratamiento con tofacitinib a menos que no se pueda utilizar otra alternativa terapéutica. La ficha técnica y el prospecto, así como el material sobre prevención de riesgos (material informativo sobre seguridad) de tofacitinib, se actualizarán para incluir esta nueva información. 
Se recuerda la importancia de notificar los acontecimientos adversos graves o desconocidos en relación con la administración de vacunas frente a la COVID-19 al Centro Autonómico de Farmacovigilancia correspondiente o a través del formulario electrónico disponible en www.notificaRAM.es. ANEXO: RESULTADOS PRELIMINARES SOBRE RIESGO CARDIOVACULAR Y DE MALIGNIDAD DELESTUDIO A3921133Tasa de incidencia y cociente de riesgo (hazard ratio: HR) de MACE e infarto de miocardio Resultados globales 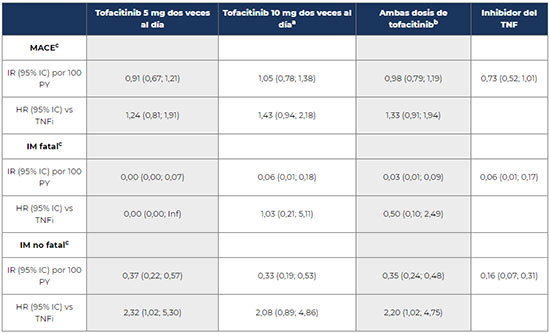 a El grupo de tratamiento de tofacitinib 10 mg dos veces al día incluye datos de pacientes que cambiaron de tofacitinib 10 mg dos veces al día a tofacitinib 5 mg dos veces al día como resultado de una modificación del estudio. Pacientes de 65 años de edad o mayores 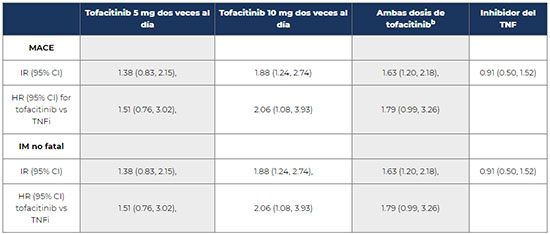 Tasa de incidencia y cociente de riesgo de neoplasias malignas excluyendo CPNMa 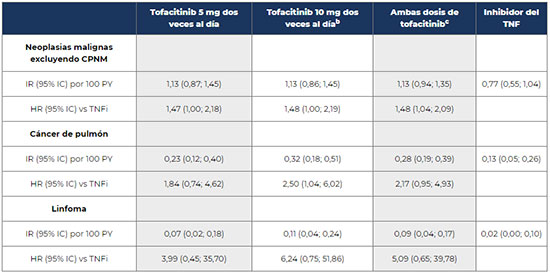 a De acuerdo a los eventos ocurridos durante el tratamiento o tras discontinuación del tratamiento hasta el fin del estudio. [1] El informe final del estudio se espera para finales del próximo mes de agosto. [2] Definidos en el protocolo del estudio como ser fumador actual, tener hipertensión, lipoproteínas de alta densidad (HDL) <40 mg/dl, diabetes mellitus, antecedentes de enfermedad arterial coronaria, antecedentes familiares de enfermedad coronaria precoz, artritis reumatoide extraarticular. |
| Enlaces de Interés | ||||||||||
|
|
|||||||||
| Fuente: Agencia Española de Medicamentos y Productos Sanitarios |

