Última Información
- Principios Activos
- Alertas
- Problemas Suministro
- Actualización monografías Principios Activos
- Noticias
Bristol Myers Squibb comunica nuevas investigaciones en los Congresos ASCO y EHA 2021 mostrando nuevas aproximaciones y un progreso significativo en la mejora de la supervivencia en cáncer y las enfermedades hematológicas
VADEMECUM - 23/06/2021 CONGRESOS / FORMACIÓNLos primeros datos fase 3 del ensayo RELATIVITY-047 destacan el beneficio clínico del anticuerpo anti-LAG-3 relatlimab - el tercer inhibidor del punto de control que desarrolla BMS- en combinación con nivolumab en pacientes con melanoma metastásico o irresecable no tratados previamente.

Bristol Myers Squibb (NYSE: BMY) anunció la comunicación de diferentes trabajos de investigación que demuestran el potencial de sus medicamentos para alcanzar una supervivencia a largo plazo, mejorar los resultados y abordar áreas con una elevada necesidad médica en distintos tumores y trastornos hematológicos en el Congreso Anual Virtual de 2021 de la American Society of Clinical Oncology (ASCO), y en el Congreso virtual de 2021 de la European Hematology Association (EHA). Se presentaron en las dos reuniones datos de más de 75 estudios promovidos por la compañía, estudios académicos independientes y colaboraciones en las que se evalúan compuestos en 18 tipos de cáncer y trastornos hematológicos, incluidos dos abstracts (Abstract n.º 9503 y n.º LBA4001) seleccionados para el programa de prensa oficial de la ASCO y, uno (Abstract n.º S101), para el simposio presidencial de la EHA. “La amplitud de nuestros datos presentados este año muestran nuestra diversa cartera de productos en desarrollo, con numerosas estrategias dirigidas a abordar la biología subyacente del cáncer y los trastornos hematológicos,” dijo Samit Hirawat, M.D., vicepresidente ejecutivo, principal responsable médico de desarrollo internacional de fármacos de Bristol Myers Squibb. “A través de nuestros amplios programas de investigación, estamos explorando cómo las combinaciones de inmunoterapia pueden mejorar los resultados de supervivencia en pacientes oncológicos, siendo pioneros en avances significativos en la terapia celular y la maduración eritroide y aprovechando décadas de experiencia en la degradación de proteínas para evaluar agentes más potentes. A medida que evolucionamos en el desarrollo de nuevas terapias, reconocemos que las necesidades de los pacientes se extienden más allá del tratamiento, y tenemos el compromiso de apoyar todos los aspectos relacionados con el cuidado y la asistencia a los pacientes. En colaboración con instituciones y con la comunidad científica, estamos trabajando para mejorar el apoyo a los supervivientes y hacer avanzar la equidad sanitaria en un momento en el que las disparidades en la asistencia se han convertido en un problema cada vez más acuciante." Entre los datos fundamentales presentados por Bristol Myers Squibb en SCO y EHA 2021 están: Tumores sólidos · Primera presentación de los resultados del ensayo RELATIVITY-047, que evalúa el anticuerpo anti-LAG-3 relatlimab, el tercer inhibidor del punto de control que tiene la compañía y última innovación en este campo, demostrando el beneficio clínico en pacientes en una combinación a dosis fijas con nivolumab. Estos datos fueron parte del programa de prensa oficial de ASCO del 14 de mayo de 2021. · Los datos de supervivencia con mayor seguimiento que se han presentado jamás de la combinación de nivolumab (Opdivo) más ipilimumab (Yervoy) del estudio CheckMate ‑067, que demuestran beneficios mantenidos en supervivencia a lo largo de 6,5 años en pacientes con melanoma avanzado o metastásico. · Primera revelación de datos del ensayo CheckMate ‑648, en el que se demuestra un beneficio en la supervivencia con nivolumab más quimioterapia y nivolumab más ipilimumab, así como datos adicionales de eficacia y seguridad del ensayo CheckMate ‑649, de manera que ambos ensayos respaldan la eficacia superior, en primera línea, demostrada por nivolumab en pacientes con tumores gastrointestinales del tracto superior con elevadas necesidades aún no satisfechas. Los datos del ensayo CheckMate ‑648 fueron parte del programa de prensa oficial de la ASCO del 28 de mayo de 2021. · Ampliación de los resultados de eficacia y seguridad del ensayo CheckMate ‑577, el primer y único ensayo en demostrar una eficacia superior de nivolumab en monoterapia en el contexto adyuvante en pacientes con cáncer esofágico o de la unión esofagogástrica. · Datos a dos y cuatro años de los ensayos CheckMate ‑9LA y CheckMate ‑227, que refuerzan el papel de las combinaciones que contienen nivolumab más ipilimumab para mejorar la supervivencia a largo plazo en pacientes con cáncer de pulmón no microcítico (CPNM) en el contexto de primera línea. · Datos de resultados quirúrgicos del ensayo CheckMate ‑816 que demuestran el potencial del tratamiento neoadyuvante con nivolumab más quimioterapia para aumentar la respuesta patológica sin afectar negativamente a la cirugía en pacientes con CPNM en estadios más precoces. Hematología · Resultados de eficacia y seguridad a plazo más largo presentados en colaboración con bluebird bio del estudio pivotal KarMMa de idecabtagene vicleucel (Abecma), la primera terapia con células CAR T dirigida a BCMA, en pacientes con mieloma múltiple en recaída o refractario, que refuerzan el compromiso de la compañía con el avance de las terapias celulares. · Primera comunicación de datos del estudio fase 2 BEYOND de luspatercept (Reblozyl), un agente de maduración eritroide, primero en su clase, junto al mejor tratamiento de apoyoque demuestra su beneficio clínico y su potencial en pacientes con beta (β)-talasemia no dependiente de transfusión . Estos datos son parte del resumen de prensa oficial de la EHA y del simposio presidencial el 11 de junio, 2021. · Nuevos datos de combinación del estudio fase 1/2 MM-001 de iberdomida, que destacan el potencial de los compuestos CELMoD® en pacientes con mieloma múltiple en recaída y refractario y subrayan la base en investigación acerca de la degradación de proteínas de la compañía . · Análisis de supervivencia global (SG) y supervivencia libre de progresión (SLP) de fedratinib (Inrebic), el primer tratamiento aprobado en Europa para la mielofibrosis encasi una década, de los estudios JAKARTA y JAKARTA-2 en pacientes con mielofibrosis de nuevo diagnóstico y tratada previamente. · Nuevos avances del ensayo QUAZAR AML-001 que confirman los beneficios en supervivencia de azacitidina en comprimidos; (Onureg; CC-486) en diferentes subtipos de la enfermedad y diferentes características basales en pacientes con leucemia mieloide aguda (LMA) en el contexto del tratamiento de mantenimiento. Resumen de las presentaciones Algunos estudios seleccionados de Bristol Myers Squibb en la Reunión Anual Virtual de ASCO 2021 son: 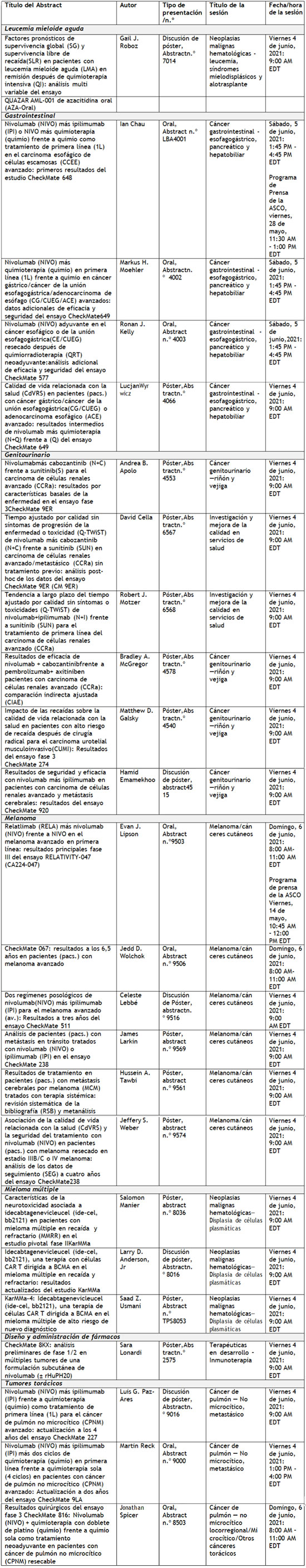 Algunos estudios seleccionados de Bristol Myers Squibb en el Congreso Anual Virtual de EHA 2021: 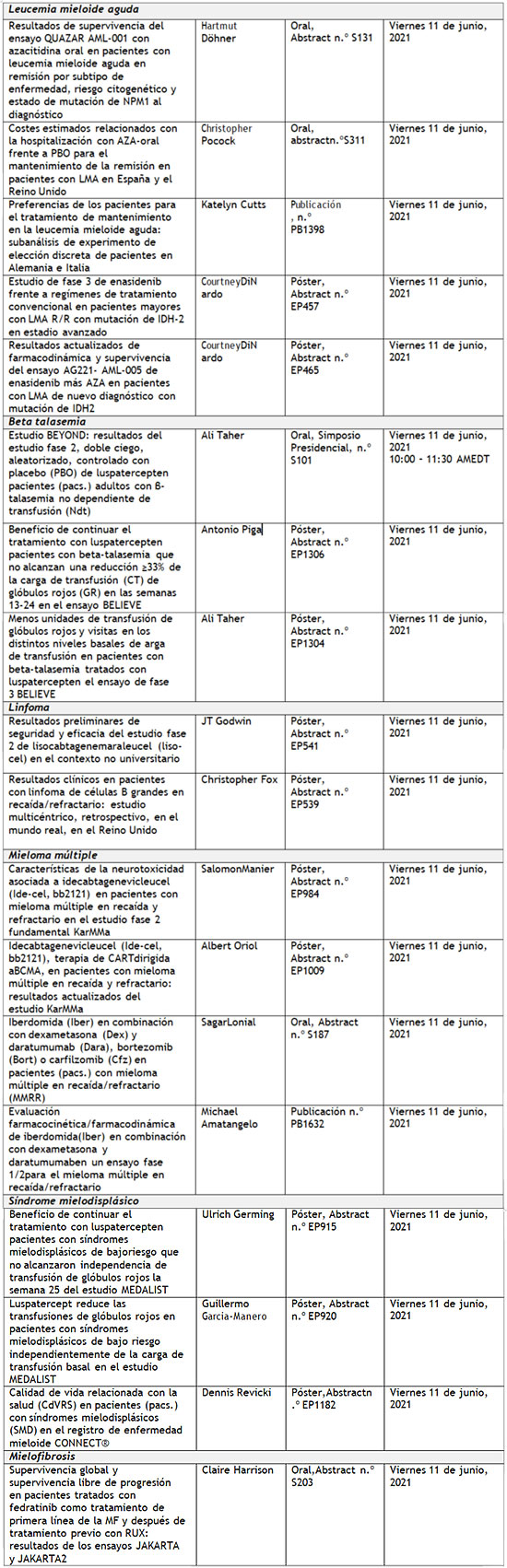 Para más información de Opdivo, Yervoy o Inrebic , consulte la ficha técnica de producto. Cautionary Statement Regarding Forward-Looking Statements This press release contains “forward-looking statements” within the meaning of the Private Securities Litigation Reform Act of 1995 regarding, among other things, the research, development and commercialization of pharmaceutical products. All statements that are not statements of historical facts are, or may be deemed to be, forward-looking statements. Such forward-looking statements are based on historical performance and current expectations and projections about our future financial results, goals, plans and objectives and involve inherent risks, assumptions and uncertainties, including internal or external factors that could delay, divert or change any of them in the next several years, that are difficult to predict, may be beyond our control and could cause our future financial results, goals, plans and objectives to differ materially from those expressed in, or implied by, the statements. These risks, assumptions, uncertainties and other factors include, among others, that future study results will be consistent with the results to date, that the treatments and combination treatments may not receive regulatory approval for the indications described in this release in the currently anticipated timeline or at all and, if approved, whether such treatments or combination treatments for such indications described in this release will be commercially successful. No forward-looking statement can be guaranteed. Forward-looking statements in this press release should be evaluated together with the many risks and uncertainties that affect Bristol Myers Squibb’s business and market, particularly those identified in the cautionary statement and risk factors discussion in Bristol Myers Squibb’s Annual Report on Form 10-K for the year ended December 31, 2020, as updated by our subsequent Quarterly Reports on Form 10-Q, Current Reports on Form 8-K and other filings with the Securities and Exchange Commission. The forward-looking statements included in this document are made only as of the date of this document and except as otherwise required by applicable law, Bristol Myers Squibb undertakes no obligation to publicly update or revise any forward-looking statement, whether as a result of new information, future events, changed circumstances or otherwise. 
Fuente: BCW |
| Enlaces de Interés | |||||||||||||||
|
|
||||||||||||||
Bristol Myers Squibb comunica nuevas investigaciones en los Congresos ASCO y EHA 2021 mostrando nuevas aproximaciones y un progreso significativo en la mejora de la supervivencia en cáncer y las enfermedades hematológicas
VADEMECUM - 23/06/2021 CONGRESOS / FORMACIÓNLos primeros datos fase 3 del ensayo RELATIVITY-047 destacan el beneficio clínico del anticuerpo anti-LAG-3 relatlimab - el tercer inhibidor del punto de control que desarrolla BMS- en combinación con nivolumab en pacientes con melanoma metastásico o irresecable no tratados previamente.

Si usted es profesional sanitario podrá consultar la información completa. Para ello debe conectarse con su email y contraseñ o registrarse.
Bristol Myers Squibb comunica nuevas investigaciones en los Congresos ASCO y EHA 2021 mostrando nuevas aproximaciones y un progreso significativo en la mejora de la supervivencia en cáncer y las enfermedades hematológicas
VADEMECUM - 23/06/2021 CONGRESOS / FORMACIÓNLos primeros datos fase 3 del ensayo RELATIVITY-047 destacan el beneficio clínico del anticuerpo anti-LAG-3 relatlimab - el tercer inhibidor del punto de control que desarrolla BMS- en combinación con nivolumab en pacientes con melanoma metastásico o irresecable no tratados previamente.

Sólo determinadas especialidades médicas pueden visualizar esta noticia.

