TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO
| ATC: Tecnecio (99m Tc) pertecnetato |
| PA: Pertecnetato (TC-99M) de sodio |
| EXC: Sodio y otros. |
Envases
2. - COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
3. - FORMA FARMACÉUTICA
4. - DATOS CLÍNICOS
5. - PROPIEDADES FARMACOLÓGICAS
6. - DATOS FARMACÉUTICOS
7. - TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
8. - NÚMERO(S) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
9. - FECHA DE LA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
10. - FECHA DE LA REVISIÓN DEL TEXTO
 1. - NOMBRE DEL MEDICAMENTO
1. - NOMBRE DEL MEDICAMENTO
TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
 2. - COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
2. - COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
La inyección de pertecnetato (99mTc) de sodio se produce por medio de un generador (99Mo/99mTc). El tecnecio (99mTc) decae con emisión de radiación gamma con una energía media de 140 keV y un semiperíodo de 6,01 horas, dando lugar a tecnecio (99Tc) que, dado su período de semidesintegración prolongado de 2,13 ? 105 años, puede ser considerado como casi estable.
El generador de radionucleido contiene el isótopo padre 99Mo adsorbido en una columna de cromatografía, de la que se eluye el pertecnetato (99mTc) de sodio inyectable en solución estéril.
El 99Mo de la columna se encuentra en equilibrio con el isótopo hijo formado 99mTc. Los generadores se suministran con las siguientes cantidades radiactivas de 99Mo en la hora de referencia que libera las siguientes cantidades de tecnecio (99mTc):
| Actividad 99mTc (Radiactividad máxima eluible en la fecha de calibración, 12:00 CET) | 2 | 4 | 6 | 8 | 10 | 12 | 16 | 20 | 25 | 50 | GBq |
| Radiactividad de 99Mo (en la fecha de calibración, 12:00 CET) | 2,5 | 5 | 7 | 9,5 | 12 | 14,5 | 19 | 24 | 30 | 60 | GBq |
Las cantidades de tecnecio (99mTc) disponibles en cada elución dependen del rendimiento real del tipo de generador utilizado declarado por el fabricante y aprobado por la autoridad nacional competente.
Excipiente(s) con efecto conocido
Cada ml de la solución de pertecnetato (99mTc) de sodio contiene 3,6 mg de sodio. Para consultar la lista completa de excipientes ver sección 6.1.
 3. - FORMA FARMACÉUTICA
3. - FORMA FARMACÉUTICA
Generador de radionucleido.
La solución eluída es una solución clara e incolora de pertecnetato (99mTc) de sodio, con un pH
comprendido entre 4,5 y 7,5.
 4. - DATOS CLÍNICOS
4. - DATOS CLÍNICOS
 4.1 - Indicaciones Terapéuticas de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
4.1 - Indicaciones Terapéuticas de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
Este medicamento es únicamente para uso diagnóstico.
El eluido del generador de radionucleido (pertecnetato (99mTc) de sodio inyectable) está indicado para:
? El marcaje de varios equipos para preparación radiofarmacéutica desarrollados y aprobados para el radiomarcado con una solución de este tipo.
? Gammagrafía tiroidea: obtención directa de imágenes y medición de la captación tiroidea para obtener información sobre el tamaño, posición, nodularidad y función de la glándula en el caso de enfermedad tiroidea.
? Gammagrafía salival: diagnóstico de sialoadenitis crónica (p. ej., en el síndrome de Sjögren) y evaluación de la función de las glándulas salivales y permeabilidad de sus conductos en trastornos de las mismas, así como el seguimiento de la respuesta a las intervenciones terapéuticas (en particular, al tratamiento con yodo radiactivo).
? Localización de mucosa gástrica ectópica (divertículo de Meckel)
? Gammagrafía de conductos lacrimales, para evaluar trastornos funcionales del lagrimeo y vigilancia de la respuesta a intervenciones terapéuticas.
 4.2 - Posología y administración de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
4.2 - Posología y administración de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
 4.3 - Contraindicaciones de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
4.3 - Contraindicaciones de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
 4.4 - Advertencias y Precauciones de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
4.4 - Advertencias y Precauciones de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
Posibilidad de reacciones de hipersensibilidad o anafilácticas
Si se produce una reacción de hipersensibilidad o anafiláctica, la administración del medicamento debe suspenderse inmediatamente e iniciar el tratamiento intravenoso, si fuera necesario. Para permitir la acción inmediata en caso de urgencia, los medicamentos y equipos necesarios como el tubo endotraqueal y el respirador, deberán estar disponibles inmediatamente.
Justificación individual del balance beneficio/riesgo
La exposición a la radiación en cada paciente debe justificarse por el beneficio probable. La actividad administrada debe ser en todo caso la más baja que permita obtener razonablemente la información diagnóstica requerida.
Insuficiencia renal
Es necesario prestar atención a la relación beneficio-riesgo, ya que es posible un aumento de la exposición a la radiación en esos pacientes.
Población pediátrica
Para información sobre el uso en población pediátrica, ver sección 4.2.
Es necesario prestar especial atención a la indicación, ya que la dosis eficaz por MBq es mayor que en los adultos (ver sección 11).
El bloqueo tiroideo es de especial importancia en la población de pacientes pediátricos, a excepción de la gammagrafía tiroidea.
Preparación del paciente
En determinadas indicaciones puede ser necesario el tratamiento previo de los pacientes con agentes bloqueantes del tiroides o con agentes reductores.
El paciente debe estar perfectamente hidratado antes del comienzo de la exploración y se le pedirá que orine con la máxima frecuencia posible durante las primeras horas tras la exploración, para reducir la exposición a la radiación.
Para evitar falsos positivos o reducir al mínimo la irradiación por reducción de la acumulación de pertecnetato en las glándulas tiroides y salivales, se debe administrar un agente de bloqueo tiroideo antes de la gammagrafía del conducto lagrimal o de la gammagrafía del divertículo de Meckel. Por el contrario, NO se debe utilizar un agente bloqueante del tiroides antes de la gammagrafía tiroidea, paratiroidea o salival.
Antes de aplicar la solución de pertecnetato (99mTc) de sodio para la gammagrafía del divertículo de
Meckel, el paciente debe tener el estómago vacío durante 3-4 horas para reducir el peristaltismo intestinal.
Después del marcaje in vivo de los eritrocitos con iones estañosos para la reducción del pertecnetato (99mTc) de sodio, el complejo de 99mTc se acumula principalmente en los eritrocitos, por lo que la gammagrafía del divertículo de Meckel se debe realizar antes o algunos días después del marcaje in vivo de los eritrocitos.
Después del procedimiento
El contacto cercano con lactantes y mujeres gestantes deberá limitarse durante 12 horas.
Advertencias específicas
La solución de pertecnetato (99mTc) de sodio inyectable contiene 3,6 mg/ml de sodio.
Dependiendo del momento en que se administre la inyección, el contenido de sodio administrado al paciente puede ser en algunos casos mayor de 1 mmol (23 mg). Este dato debe tenerse en cuenta en pacientes que reciban una dieta baja en sodio.
Cuando se utilizan soluciones de pertecnetato (99mTc) de sodio para el marcaje de un equipo de reactivos, se debe tener en cuenta el sodio derivado del eluido y del equipo de reactivos en la determinación del contenido total de sodio. Por favor, consulte el prospecto del equipo de reactivos.
En la gammagrafía salivar cabe esperar una menor especificidad del método respecto a la sialografía con resonancia magnética.
Para las precauciones sobre el peligro medioambiental, ver sección 6.6.
 4.5 - Interacciones con otros medicamentos de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
4.5 - Interacciones con otros medicamentos de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
La atropina, la isoprenalina y los analgésicos pueden retrasar el vaciamiento gástrico y, por tanto, la redistribución de pertecnetato (99mTc) en el estudio radiológico abdominal.
La administración de laxantes debe suspenderse, ya que provocan irritación del tubo digestivo. Los estudios con contraste (p. ej., bario) y las exploraciones del tracto digestivo superior deben evitarse en las 48 horas siguientes a la administración del pertecnetato (99mTc) para una gammagrafía del divertículo de Meckel.
Se sabe que son muchos los medicamentos que modifican la captación tiroidea.
- los fármacos antitiroideos (p. ej., carbimazol u otro derivado imidazol como propiltiouracilo), salicilatos, esteroides, nitroprusiato sódico, sulfobromftaleína sódica o perclorato deben ser retirados 1 semana antes de la gammagrafía del tiroides;
- la fenilbutazona y los expectorantes deben ser retirados durante 2 semanas;
- los preparados de tiroides naturales o sintéticos (p. ej., tiroxina sódica, liotironina sódica o extracto de tiroides) deben ser retirados durante 2-3 semanas;
- la amiodarona, las benzodiazepinas o el litio deben ser retirados durante 4 semanas;
- los medios de contraste con ioduro no se pueden administrar en 1-2 meses.
 4.6 - Embarazo y Lactancia de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
4.6 - Embarazo y Lactancia de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
Mujeres en edad fértil
Cuando se prevea la administración de un radiofármaco a una mujer en edad fértil, es importante determinar si está o no embarazada. Toda mujer que haya tenido una falta debe considerarse embarazada hasta que se demuestre lo contrario. En caso de duda sobre un potencial embarazo (si la mujer tiene una
falta, si el período es muy irregular, etc.), se deben ofrecer a la paciente técnicas alternativas en las que no se utilice radiación ionizante (si fuera posible).
Embarazo
La administración de pertecnetato (99mTc) a una mujer que se sabe que está embarazada debe estar justificada por la necesidad médica y por una evaluación individual positiva del beneficio riesgo para la madre y el feto. Deben tenerse en cuenta modalidades de diagnóstico alternativo no irradiantes.
Se ha comprobado que el 99mTc (como pertecnetato libre) atraviesa la barrera placentaria. Lactancia
Antes de administrar un producto radiofarmacéutico a una madre que esté amamantando se deberá valorar la posibilidad de retrasar la administración del radionucleido hasta que haya terminado la lactancia y, en lo que respecta a la elección más apropiada del radiofármaco, se deberá tener en cuenta la secreción de actividad en la leche materna. Si la administración se considerara necesaria, se suspenderá la lactancia durante 12 horas después de la administración y se desechará la leche extraída.
Durante este período se deberá restringir el contacto cercano con lactantes.
 4.7 - Efectos sobre la capacidad de conducción de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
4.7 - Efectos sobre la capacidad de conducción de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
La influencia de pertecnetato sódico (99mTc) sobre la capacidad para conducir y utilizar máquinas es nula.
 4.8 - Reacciones Adversas de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
4.8 - Reacciones Adversas de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
Resumen del perfil de seguridad
La información sobre reacciones adversas procede de comunicaciones espontáneas. Las reacciones notificadas comprenden reacciones anafilactoides, reacciones vegetativas, y distintos tipos de reacciones en el lugar de la inyección. El pertecnetato (99mTc) de sodio procedente del generador del radionúclido Tekcis se utiliza para el marcado radioactivo de varios compuestos que, en general, tienen un potencial de reacciones adversas mayor que el de 99mTc. En consecuencia, es probable que las reacciones adversas notificadas guarden más relación con los compuestos marcados que con el 99mTc. Los posibles tipos de reacciones adversas que pueden darse después de la administración intravenosa de una preparación radiofarmacéutica marcada con 99mTc dependerán del compuesto que se utilice en cada caso. Esta información puede encontrarse en la ficha técnica del equipo de reactivos utilizado para preparar el radiofármaco.
Lista tabulada de reacciones adversas
Las frecuencias de las reacciones adversas se definen como sigue:
Frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Trastornos del sistema inmunológico
Frecuencia no conocida*: reacciones anafilactoides (p. ej., disnea, coma, urticaria, eritema, erupción cutánea, prurito, edema en diferentes localizaciones, como, por ejemplo, edema facial)
Trastornos del sistema nervioso
Frecuencia no conocida*: reacciones vasovagales (p. ej., síncope, taquicardia, bradicardia, mareo, cefalea, visión borrosa, rubefacción)
Trastornos gastrointestinales
Frecuencia no conocida*: vómitos, náuseas, diarrea
Trastornos generales y alteraciones en el lugar de administración
Frecuencia no conocida*: reacciones en el lugar de inyección debidas a extravasación (p. ej., celulitis, dolor, eritema, hinchazón )
*Reacciones adversas procedentes de comunicaciones espontáneas
La exposición a radiaciones ionizantes está relacionada con la inducción del cáncer y la posibilidad de que se produzcan defectos hereditarios. Como la dosis eficaz es de 5,2 mSv cuando se administra la actividad máxima recomendada de 400 MBq, la probabilidad de que se presenten estas reacciones adversas es baja.
Descripción de las reacciones adversas seleccionadas
Reacciones anafilactoides (p. ej., disnea, coma, urticaria, eritema, erupción cutánea, prurito, edema en diferentes localizaciones [p. ej., edema facial]).
Las reacciones anafilácticas se han notificado después de la inyección intravenosa de pertecnetato (99mTc) de sodio e incluyen diversos síntomas de la piel o respiratorios, como irritaciones de la piel, edema o disnea.
Reacciones vegetativas (trastornos del sistema nervioso y gastrointestinal)
Se han notificado casos aislados de reacciones vegetativas graves, sin embargo, la mayoría de las reacciones vegetativas notificadas incluyen reacciones gastrointestinales, como náuseas o vómitos. Otras notificaciones incluyen reacciones vasovagales, como cefalea o mareos. Las reacciones vegetativas se consideran más bien relacionadas con el desarrollo del estudio que con el tecnecio (99mTc), especialmente en pacientes ansiosos.
Trastornos generales y alteraciones en el lugar de administración
Otras notificaciones describen reacciones locales en el lugar de la inyección. Estas reacciones están relacionadas con la extravasación del material radiactivo durante la inyección, y las reacciones notificadas van desde inflamación local hasta celulitis. Dependiendo de la radiactividad administrada y del compuesto marcado, la extravasación extendida puede requerir tratamiento quirúrgico.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es
 4.9 - Sobredosificación de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
4.9 - Sobredosificación de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
En caso de sobredosis de pertecnetato (99mTc) de sodio, la dosis de radiación absorbida deberá reducirse siempre que sea posible aumentando la eliminación del radionucleido del cuerpo mediante defecación, diuresis forzada y orinando con frecuencia.
La captación del tiroides, glándulas salivales y mucosa gástrica puede reducirse significativamente si se administra perclorato sódico o potásico inmediatamente después de administrarse accidentalmente una dosis alta de pertecnetato (99mTc) de sodio.
 5. - PROPIEDADES FARMACOLÓGICAS
5. - PROPIEDADES FARMACOLÓGICAS
 5.1 - Propiedades farmacodinámicas de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
5.1 - Propiedades farmacodinámicas de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
Grupo farmacoterapéutico: Radiofármacos para diagnóstico, Radiofármacos para uso diagnóstico del tiroides, varios, código ATC: V09FX01
No se ha observado actividad farmacológica en el rango de dosis administradas con fines diagnósticos.
 5.2 - Propiedades farmacocinéticas de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
5.2 - Propiedades farmacocinéticas de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
Distribución
El ion pertecnetato tiene una distribución biológica similar a la de los iones yoduro y perclorato, concentrándose temporalmente en las glándulas salivales, plexo coroideo, estómago (mucosa gástrica) y glándula tiroidea, de los cuales se elimina sin metabolizar. El ion pertecnetato también tiende a concentrarse en áreas con aumento de vascularización, en particular cuando el pretratamiento con agentes bloqueantes inhibe la captación en estructuras glandulares. Cuando la barrera hematoencefálica está intacta, el pertecnetato (99mTc) de sodio no penetra en el tejido cerebral.
Captación por los órganos
En sangre, el 70-80% de la dosis inyectada de pertecnetato (99mTc) de sodio por vía intravenosa se une a las proteínas, principalmente a la albúmina de forma inespecífica. La fracción libre (20-30%) se acumula temporalmente en el tiroides y glándulas salivales, estómago y mucosas nasales, así como en el plexo coroideo.
Al contrario que el yodo, el pertecnetato (99mTc) de sodio no es utilizado para la síntesis de hormonas tiroideas (organificación) ni es absorbido por el intestino delgado. En el tiroides, la acumulación máxima se alcanza, dependiendo del estado funcional y de la saturación de yodo (en eutiroidismo, aproximadamente el
0,3-3%, en hipertiroidismo y depleción de yodo, hasta el 25%) unos 20 minutos después de la inyección y después disminuye rápidamente. Lo mismo puede decirse de las células parietales de la mucosa gástrica y de las células acinares de las glándulas salivales.
Al contrario que en el tiroides, donde el pertecnetato (99mTc) de sodio se vuelve a liberar al torrente sanguíneo, las glándulas salivales y el estómago secretan pertecnetato (99mTc) de sodio en la saliva y el jugo gástrico, respectivamente. La acumulación en la glándula salival alcanza una magnitud del 0,5% de la actividad aplicada, alcanzando el máximo a los 20 minutos. Una hora después de la inyección, la concentración en la saliva es 10-30 veces mayor que en el plasma. La excreción se puede acelerar con zumo de limón o estimulando el sistema nervioso parasimpático, y la absorción disminuye con perclorato.
Eliminación
El período de semidesintegración en el plasma es de aproximadamente 3 horas. El pertecnetato (99mTc) de sodio no es metabolizado en el organismo. Una fracción se elimina con gran rapidez por vía renal y el resto lo hace más lentamente a través de las heces, la saliva y el líquido lagrimal. La excreción durante las primeras 24 horas tras su administración tiene lugar principalmente por la orina (aproximadamente el 25
%) y la excreción fecal se produce en las siguientes 48 horas. Aproximadamente el 50 % de la actividad administrada se excreta en las primeras 50 horas. Cuando se inhibe la captación selectiva de pertecnetato (99mTc) en las estructuras glandulares mediante la administración previa de agentes bloqueantes, la excreción tiene lugar por las mismas vías pero con un mayor aclaramiento renal.
Los datos anteriores no son válidos cuando se utiliza pertecnetato (99mTc) de sodio para el marcaje de otro radiofármaco.
 5.3 - Datos preclínicos sobre seguridad de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
5.3 - Datos preclínicos sobre seguridad de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
No existe información sobre la toxicidad aguda, subaguda y crónica por la administración de una dosis única o de dosis repetidas. La cantidad de pertecnetato (99mTc) de sodio administrada durante los procedimientos clínicos de diagnóstico es muy pequeña y, aparte de las reacciones alérgicas no se han descrito otras reacciones adversas.
Este medicamento no está destinado a la administración periódica o continuada. No se han realizado estudios de mutagenia y carcinogenia a largo plazo. Toxicidad reproductiva:
El paso transplacentario del 99mTc a partir del pertecnetato (99mTc) de sodio administrado por vía
intravenosa se ha estudiado en ratones. El útero gestante contenía hasta el 60% del 99mTc inyectado cuando se utilizó sin administrar perclorato previamente. Los estudios realizados en hembras de ratón preñadas durante la gestación, gestación y lactancia y sólo lactancia demostraron cambios en la progenie con disminución del peso, ausencia del pelo y esterilidad.
 6. - DATOS FARMACÉUTICOS
6. - DATOS FARMACÉUTICOS
 6.1 - Lista de excipientes de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
6.1 - Lista de excipientes de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
? Sistema de columna: Óxido de aluminio.
? Bolsa de solución para elución:
Cloruro de sodio, nitrato de sodio y agua para preparaciones inyectables.
 6.2 - Incompatibilidades de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
6.2 - Incompatibilidades de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
Este medicamento no debe mezclarse con otros, excepto con los mencionados en la sección 12.
 6.3 - Período de validez de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
6.3 - Período de validez de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
Generador: 21 días desde la fecha de fabricación.
La fecha de calibración y la fecha de caducidad figuran en la etiqueta.
Eluido de pertecnetato (99mTc) de sodio: Después de la elución, utilizar antes de 10 horas hasta 10 extracciones.
Este medicamento no requiere condiciones especiales de conservación. Viales para elución: 24 meses.
 6.4 - Precauciones especiales de conservación de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
6.4 - Precauciones especiales de conservación de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
Generador: Este medicamento no requiere condiciones especiales de conservación.
Eluido: Para las condiciones de conservación del radiofármaco tras la elución, ver sección 6.3.
Viales de vacío: No conservar a temperatura superior a 25ºC.
Los procedimientos de conservación deben cumplir las normas nacionales sobre materiales radiactivos.
 6.5 - Naturaleza y contenido del recipiente de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
6.5 - Naturaleza y contenido del recipiente de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
El generador Tekcis se suministra en un contenedor tipo A para transporte. Contiene:
? Una bolsa de polipropileno blando de 250 ml que contiene la solución para elución (1). Se conecta con una aguja de acero inoxidable (2) con la parte superior de la columna cromatográfica;
? Una columna cromatográfica de vidrio (3) cerrada en ambos extremos mediante tapones de silicona rellenos con aglomerado de fritados de acero inoxidable (4). Esta columna contiene alúmina sobre la cual se adsorbe el molibdeno 99.
? Una aguja de salida (5) conectada con la parte inferior de la columna, mientras que el otro extremo de la aguja (6) puede conectarse con un vial de elución para eluir la columna, o con un vial protector (STE- ELU) para mantener la esterilidad entre dos eluciones.
La columna de alúmina y la aguja están protegidas por un blindaje cilíndrico-cónico de plomo o tungsteno (7). Los generadores de hasta 25 GBq de tecnecio (99mTc) están protegidos por un blindaje de plomo, y en los de 50 GBq se utiliza un blindaje de tungsteno.
Todo el sistema se introduce en una cubierta paralelepípeda de plástico moldeado (23 ? 21 ? 14 cm) (8-9). La aguja para elución surge de la parte inferior de la cubierta de plástico, protegida por una caperuza o un
vial protector para el transporte (STE-ELU).
Hay una válvula de seguridad (10), cerrada durante el transporte, situada cerca de la aguja de elución. Accesorios suministrados con el generador:
? Una bolsa de 10 viales para elución, apirógenos y parcialmente al vacío (TC-ELU-5) (11), que permite eluciones de 5 a 6 ml.
? Un vial protector estéril para la aguja de elución (STE-ELU). Cada vial de elución o vial protector consiste en un vial incoloro de 15 ml de vidrio tipo I de la Ph. Eur., cerrado con un tapón de goma y sellado con una cápsula de aluminio.
? Se proporciona un contenedor para elución (12) con el primer envío.
Otros accesorios:
? Kits que contienen 50 o 150 viales ? 15 ml:
o Viales parcialmente al vacío que permiten la elución de 5 a 6 ml ;
o Viales parcialmente al vacío que permiten la elución de 9 a 11 ml ;
o Viales al vacío que permiten la elución de 14 a 16 ml.
? Blindaje de plomo adicional adaptado al generador Tekcis: PROTECT ELU. Actividad del generador:
Diagrama del generador Tekcis en el modo elución
12
9 11
10
6
2
3
1 4
5
7
8
1 Bolsa de solución para elución Escudo cilíndrico-cónico de plomo o 7 tungsteno
2 Aguja de conexión Cubierta de plástico inferior 8
3 Columna de cromatografía de vidrio Cubierta de plástico superior 9
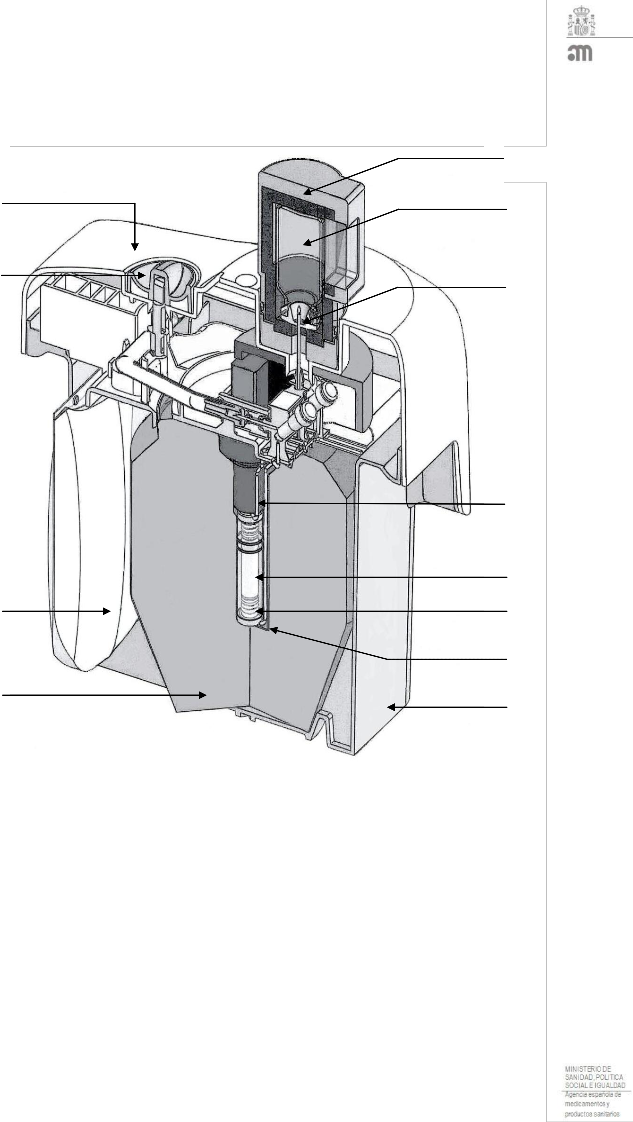
4 Tapón de silicona + aglomerado de fritados de acero inoxidable
Válvula de seguridad 10
5 Aguja de salida de acero inoxidable Vial para elución 11
6 Aguja de elución Contenedor para la elución 12
 6.6 - Precauciones especiales de eliminación y otras manipulaciones de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
6.6 - Precauciones especiales de eliminación y otras manipulaciones de TEKCIS 2-50 GBQ GENERADOR DE RADIONUCLEIDO 2-50 MBq Generador de tecnecio (99mTc)
Advertencias generales
Los radiofármacos sólo pueden ser recibidos, utilizados y administrados por personas autorizadas en instalaciones clínicas especiales. Su recepción, conservación, uso, transferencia y eliminación están sometidos a las normas y/o licencias correspondientes de los organismos oficiales locales competentes.
Los radiofármacos deben ser preparados por el usuario cumpliendo los requisitos sobre seguridad radiológica y calidad farmacéutica. Deberán adoptarse las precauciones asépticas adecuadas.
Si en cualquier momento durante la preparación de este producto se compromete la integridad del generador o del vial que contiene el eluido el radiofármaco no debe utilizarse.
Los procedimientos de administración deben aplicarse de forma que se reduzca el riesgo de contaminación del medicamento y de irradiación de los operarios. Es obligatorio utilizar blindajes adecuados.
La administración de radiofármacos supone un riesgo para otras personas por radiación externa o contaminación a través de pérdidas de orina, vómitos, etc. Por consiguiente, se observarán las precauciones sobre protección frente a la radiación establecidas por la legislación nacional.
La actividad residual del generador debe calcularse antes de su eliminación.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
 7. - TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
7. - TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Curium Pharma Spain, S.A. Avda. Doctor Severo Ochoa, 29
28100 Alcobendas. Madrid
España
 8. - NÚMERO(S) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
8. - NÚMERO(S) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
74970
 9. - FECHA DE LA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
9. - FECHA DE LA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: Noviembre 2011. Fecha de la última renovación: 15 Junio 2018.
 10. - FECHA DE LA REVISIÓN DEL TEXTO
10. - FECHA DE LA REVISIÓN DEL TEXTO
09/2020
DOSIMETRÍA
Los datos de la lista siguiente proceden de la norma ICRP 80 y se calculan conforme a las siguientes suposiciones:
(I) Sin pretratamiento con un agente bloqueante:
![]()
| Órgano | Dosis absorbida por unidad de actividad inyectada (mGy/MBq) | ||||
| Órgano | Adultos | 15 años | 10 años | 5 años | 1 año |
| Glándulas suprarrenales | 0,0037 | 0,0047 | 0,0072 | 0,011 | 0,019 |
| Pared vesical | 0,018 | 0,023 | 0,030 | 0,033 | 0,060 |
| Superficies óseas | 0,0054 | 0,0066 | 0,0097 | 0,014 | 0,026 |
| Cerebro | 0,0020 | 0,0025 | 0,0041 | 0,0066 | 0,012 |
| Mamas | 0,0018 | 0,0023 | 0,0034 | 0,0056 | 0,011 |
| Vesícula biliar | 0,0074 | 0,0099 | 0,016 | 0,023 | 0,035 |
| Aparato digestivo | |||||
| - Pared del estómago | 0,026 | 0,034 | 0,048 | 0,078 | 0,16 |
| - Intestino delgado | 0,016 | 0,020 | 0,031 | 0,047 | 0,082 |
| - Colon | 0,042 | 0,054 | 0,088 | 0,14 | 0,27 |
| - Pared del colon ascendente | 0,057 | 0,073 | 0,12 | 0,20 | 0,38 |
| - Pared del colon descendente | 0,021 | 0,028 | 0,045 | 0,072 | 0,13 |
| Corazón | 0,0031 | 0,0040 | 0,0061 | 0,0092 | 0,017 |
| Riñones | 0,0050 | 0,0060 | 0,0087 | 0,013 | 0,021 |
| Hígado | 0,0038 | 0,0048 | 0,0081 | 0,013 | 0,022 |
| Pulmones | 0,0026 | 0,0034 | 0,0051 | 0,0079 | 0,014 |
| Músculos | 0,0032 | 0,0040 | 0,0060 | 0,0090 | 0,016 |
| Esófago | 0,0024 | 0,0032 | 0,0047 | 0,0075 | 0,014 |
| Ovarios | 0,010 | 0,013 | 0,018 | 0,026 | 0,045 |
| Páncreas | 0,0056 | 0,0073 | 0,011 | 0,016 | 0,027 |
| Médula ósea roja | 0,0036 | 0,0045 | 0,0066 | 0,0090 | 0,015 |
| Glándulas salivales | 0,0093 | 0,012 | 0,017 | 0,024 | 0,039 |
| Piel | 0,0018 | 0,0022 | 0,0035 | 0,0056 | 0,010 |
| Bazo | 0,0043 | 0,0054 | 0,0081 | 0,012 | 0,021 |
| Testículos | 0,0028 | 0,0037 | 0,0058 | 0,0087 | 0,016 |
| Timo | 0,0024 | 0,0032 | 0,0047 | 0,0075 | 0,014 |
| Tiroides | 0,022 | 0,036 | 0,055 | 0,12 | 0,22 |
| Útero | 0,0081 | 0,010 | 0,015 | 0,022 | 0,037 |
| Otros tejidos | 0,0035 | 0,0043 | 0,0064 | 0,0096 | 0,017 |
| Dosis eficaz (mSv/MBq) | 0,013 | 0,017 | 0,026 | 0,042 | 0,079 |
(II) Con pretratamiento con un agente bloqueante:
| Órgano | Dosis absorbida por unidad de actividad inyectada (mGy/MBq) cuando se ha administrado un agente bloqueante | ||||
| Adultos | 15 años | 10 años | 5 años | 1 año | |
| Glándulas suprarrenales | 0,0029 | 0,0037 | 0,0056 | 0,0086 | 0,016 |
| Pared vesical | 0,030 | 0,038 | 0,048 | 0,050 | 0,091 |
| Superficies óseas | 0,0044 | 0,0054 | 0,0081 | 0,012 | 0,022 |
| Cerebro | 0,0020 | 0,0026 | 0,0042 | 0,0071 | 0,012 |
| Mamas | 0,0017 | 0,0022 | 0,0032 | 0,0052 | 0,010 |
| Vesícula biliar | 0,0030 | 0,0042 | 0,0070 | 0,010 | 0,013 |
| Aparato digestivo | |||||
| - Pared del estómago | 0,0027 | 0,0036 | 0,0059 | 0,0086 | 0,015 |
| - Intestino delgado | 0,0035 | 0,0044 | 0,0067 | 0,010 | 0,018 |
| - Colon | 0,0036 | 0,0048 | 0,0071 | 0,010 | 0,018 |
| - Pared del colon ascendente | 0,0032 | 0,0043 | 0,0064 | 0,010 | 0,017 |
| - Pared del colon descendente | 0,0042 | 0,0054 | 0,0081 | 0,011 | 0,019 |
| Corazón | 0,0027 | 0,0034 | 0,0052 | 0,0081 | 0,014 |
| Riñones | 0,0044 | 0,0054 | 0,0077 | 0,011 | 0,019 |
| Hígado | 0,0026 | 0,0034 | 0,0053 | 0,0082 | 0,015 |
| Pulmones | 00023 | 0,0031 | 0,0046 | 0,0074 | 0,013 |
| Músculos | 0,0025 | 0,0031 | 0,0047 | 0,0072 | 0,013 |
| Esófago | 0,0024 | 0,0031 | 0,0046 | 0,0075 | 0,014 |
| Ovarios | 0,0043 | 0,0054 | 0,0078 | 0,011 | 0,019 |
| Páncreas | 0,0030 | 0,0039 | 0,0059 | 0,0093 | 0,016 |
| Médula ósea roja | 0,0025 | 0,0032 | 0,0049 | 0,0072 | 0,013 |
| Piel | 0,0016 | 0,0020 | 0,0032 | 0,0052 | 0,0097 |
| Bazo | 0,0026 | 0,0034 | 0,0054 | 0,0083 | 0,015 |
| Testículos | 0,0030 | 0,0040 | 0,0060 | 0,0087 | 0,016 |
| Timo | 0,0024 | 0,0031 | 0,0046 | 0,0075 | 0,014 |
| Tiroides | 0,0024 | 0,0031 | 0,0050 | 0,0084 | 0,015 |
| Útero | 0,0060 | 0,0073 | 0,011 | 0,014 | 0,023 |
| Otros tejidos | 0,0025 | 0,0031 | 0,0048 | 0,0073 | 0,013 |
| Dosis eficaz (mSv/MBq) | 0,0042 | 0,0054 | 0,0077 | 0,011 | 0,019 |
La dosis eficaz obtenida por la administración intravenosa de 400 MBq de pertecnetato (99mTc) de sodio a un adulto que pesa 70 kg es de 5,2 mSv aproximadamente.
Después del pretratamiento con un agente bloqueante, la administración directa de 400 MBq de pertecnetato (99mTc) de sodio a un adulto de 70 kg da lugar a una dosis eficaz de 1,7 mSv.
La dosis de radiación absorbida por el cristalino del ojo después de la administración de pertecnetato (99mTc) de sodio para la gammagrafía del conducto lagrimal es de 0,038 mGy/MBq. Se trata de una dosis eficaz equivalente a menos de 0,01 mSv con la actividad administrada de 4 MBq.
La exposición especificada a la radiación sólo es aplicable si todos los órganos que acumulan el pertecnetato (99mTc) de sodio funcionan con normalidad. El hiper o hipofuncionamiento (p. ej., del tiroides, mucosa gástrica o riñón) y los procesos prolongados con deterioro de la barrera hematoencefálica o trastornos de la eliminación renal pueden modificar la exposición a la radiación, llegando incluso a afectación local si el incremento es muy importante.
Exposición a radiaciones exteriores
| Tasa de radiación de 99Mo-99mTc en la superficie del generador (μSv/h.GBq) | Tasa de radiación de 99Mo-99mTc a 1 metro del generador (μSv/h.GBq) | |
| Escudo de plomo de 41 mm | 16 | 0,3 |
Las tasas de radiación en la superficie y la dosis acumulada dependen de muchos factores. En general, la medición de la radiación en el ambiente y durante el trabajo es crítica y se debe realizar.
INSTRUCCIONES PARA LA PREPARACIÓN DE RADIOFÁRMACOS
La elución del generador debe realizarse en instalaciones que cumplan la normativa nacional sobre seguridad del uso de radiofármacos.
La solución eluida es una solución transparente e incolora de pertecnetato (99mTc) de sodio, con un pH entre
4,5 y 7,5 y una pureza radioquímica igual o mayor del 95%.
Cuando la solución de pertecnetato (99mTc) de sodio se usa para marcado de kits se debe consultar el prospecto del equipo de reactivos correspondiente.
Método de preparación
Desinfectar el tapón de los viales de elución antes de cada elución.
Advertencia:
No utilizar etanol o etil éter para desinfectar el tapón del vial de elución, ya que podría interferir con el proceso de elución.
Durante el transporte, la esterilidad de la aguja de elución se garantiza mediante un capuchón.
Proteger la aguja de elución de posibles contaminaciones bacterianas poniendo el vial protector sobre la aguja entre dos eluciones.
Para obtener resultados satisfactorios debe seguirse la siguiente secuencia:

Primera elución:
Cuando utilice el generador por primera vez, ABRA la válvula de seguridad (10) a la posición ON ANTES de conectar el vial de elución. Nunca cierre la válvula de seguridad entre dos eluciones. Cierre la válvula de seguridad sólo en el momento de desechar el generador.
Para eluir el generador, vuelva a poner el tapón o el vial protector utilizando el contenedor de elución (A) que contiene un vial de elución al vacío que corresponde al volumen de elución deseado (13).
La elución puede observarse a través de la ventana de vidrio plomado (14) del contenedor (A). Espere dos minutos para garantizar que se completa la elución.
Compruebe la transparencia del eluido antes de su uso, y deséchelo si la solución no es transparente. Después de la elución, vuelva a poner inmediatamente el vial protector para mantener la esterilidad de la
aguja.
Volúmenes de elución
Tekcis es un generador diseñado para eluir toda la actividad disponible de tecnecio-99m en un volumen de
5 ml. Por tanto, no es necesario proceder a la elución fraccionada. No obstante, se puede realizar la elución en volúmenes más grandes: 10 ml o 15 ml.
Posibilidades de uso
La actividad declarada en la etiqueta del generador se expresa en forma de tecnecio-99m disponible en la fecha de calibración (12:00 CET).
La actividad del tecnecio-99m disponible depende de:
? La actividad del molibdeno 99 en el momento de la elución;
? El tiempo transcurrido desde la última elución.
Control de calidad
Antes de la administración se deben comprobar la radioactividad y la degradación del molibdeno (99Mo).
La prueba de degradación de molibdeno (99Mo) puede realizarse según la Ph. Eur. o con cualquier otro método validado que permita determinar un contenido de molibdeno (99Mo) menor del 0,1% de la radiactividad total en la fecha y hora de la administración.
Masa de tecnecio (99mTc + 99Tc) presente en el eluido:
El molibdeno (99Mo) se transforma en tecnecio-99m (87,6% de desintegraciones de molibdeno (99Mo)) y en tecnecio 99 (12,4% de desintegraciones de molibdeno 99). La masa total de tecnecio [(99mTc) + (99Tc)] expresada en µg de tecnecio presentes en el eluido se puede calcular aplicando la siguiente fórmula simplificada:
M (µg) = Actividad de tecnecio-99m en el eluido ? k
F
k = 5,161.10-3 (actividad expresada en GBq)
F es la relación entre el número de átomos de tecnecio-99m (N99m) y el número total de átomos de tecnecio (Nt):
F = N99m
Nt
En la tabla siguiente se presenta el valor de este índice (F) en función del intervalo entre dos eluciones:
| Horas | Días | ||||||
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | |
| 0 | - | 0,277 | 0,131 | 0,076 | 0,0498 | 0,0344 | 0,0246 |
| 3 | 0,727 | 0,248 | 0,121 | 0,072 | 0,0474 | 0,0329 | 0,0236 |
| 6 | 0,619 | 0,223 | 0,113 | 0,068 | 0,0452 | 0,0315 | 0,0227 |
| 9 | 0,531 | 0,202 | 0,105 | 0,064 | 0,0431 | 0,0302 | 0,0218 |
| 12 | 0,459 | 0,184 | 0,098 | 0,061 | 0,0411 | 0,0290 | 0,0210 |
| 15 | 0,400 | 0,168 | 0,092 | 0,058 | 0,0393 | 0,0278 | 0,0202 |
| 18 | 0,352 | 0,154 | 0,086 | 0,055 | 0,0375 | 0,0266 | 0,0194 |
| 21 | 0,311 | 0,141 | 0,081 | 0,052 | 0,0359 | 0,0256 | 0,0187 |
Ejemplos:
El tecnecio-99 m de un generador se eluye en 5 ml. La actividad medida es de 10 GBq. La elución previa se había realizado 27 horas antes.
La masa de tecnecio es:
M (µg) = 10 ? 5,161.10-3 = 0,208 µg
0,248
Es decir, 0,042 µg/ml
El tecnecio-99m de un generador se eluye 4 días después de su preparación (correspondiendo a la primera elución). Para una actividad de 10 GBq eluido en 5 ml, la masa de tecnecio es:
M(µg) = 10 x 5.161.10-3 = 1,036µg
0,0498
Es decir, 0,207 µg/ml, cinco veces más tecnecio que en el ejemplo precedente. Aunque es pequeña, esta cantidad de tecnecio puede afectar al rendimiento bajo de marcado de algunos compuestos.
El primer eluido obtenido de este generador puede utilizarse normalmente, a menos que se especifique lo contrario. Los eluídos obtenidos incluso después de 24 horas tras la última elución se pueden usar para el marcaje de equipos de reactivos, a menos que no esté permitido según las especificaciones de la Ficha Técnica del equipo de reactivos a marcar.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
La información detallada de este medicamento está disponible en la página web de la Agencia Española de
Medicamentos y Productos Sanitarios (AEMPS) (http://www.aemps.gob.es/)

