Informe de Posicionamiento Terapéutico de panobinostat (Farydak®) en mieloma múltiple
INFORME DE POSICIONAMIENTO TERAPÉUTICO
Informe de Posicionamiento Terapéutico de panobinostat (Farydak ® ) en mieloma múltiple
IPT, 45/2016
Versión 1
Fecha de publicación: 21 de noviembre de 2016 †
El mieloma múltiple sintomático (MM) es una enfermedad neoplásica que se caracteriza por una proliferación clonal de células plasmáticas (1).
Representa aproximadamente el 10% de los tumores hematológicos y en torno a un 1% de la totalidad de los tumores malignos. En la Unión Europea se diagnostican aproximadamente 39.000 nuevos casos cada año (2), con una tasa anual estandarizada por edad de 3-5 casos nuevos por cada 100.000 habitantes y año y una media de edad al diagnóstico de 66 años (2-4). En Europa, las tasas de supervivencia global a los cinco años se encuentran entre el 23% y el 47% (5) y a los 10 años se estima en un 18% (6); casi el 29% muere al año del diagnóstico (7). En España no existen estudios que permitan establecer la incidencia real del MM, aunque si es posible establecer que su incidencia alcanza el 1,1% del total de todos los tumores, con una prevalencia estimada a 5 años de 5.740 casos (8).
Desde el punto de vista de su expresividad clínica, el MM es una entidad profundamente heterogénea. Los criterios diagnósticos para MM sintomático actualmente utilizados (para diferenciarlo del MM quiescente y la gammapatía monoclonal de significado incierto) son los propuestos por el International Myeloma Working Group (IMWG). Estos criterios incluyen la infiltración de células plasmáticas en médula ósea ≥10% o una biopsia demostrando plasmocitoma y/o evidencia de daño orgánico por el MM (anemia, hipercalcemia, lesiones osteolíticas, osteopenia severa, fracturas patológicas o insuficiencia renal). Además, la presencia de ≥60% de células plasmáticas clonales en médula ósea, la presencia de dos o más lesiones focales en la RMN y una ratio de cadenas ligeras libres (afecta/ no afecta) ≥100 debería considerarse criterio suficiente para el diagnóstico de MM que requiere tratamiento (9).
En cuanto a la estratificación del riesgo, los pacientes con deleción 17p o las translocaciones t(4;14), t(14;16) y t(14;20) deben ser considerados MM de alto riesgo, mientras que la presencia de trisomías, t(11;14), t(6;14) se consideran de riesgo estándar (9).
La tasa de progresión desde MM quiescente a MM sintomático está incrementada en los casos con las anomalías genéticas de alto riesgo ya descritas. De la misma manera, otros factores como la inmunoparesia, valores elevados de paraproteína o la ausencia de células plasmáticas con inmunofenotipo no patológico, también determinan mayor riesgo de progresión desde MM quiescente a mg/m vía intravenosa los días 1, 4, 8 y 11 del ciclo de 21 días. La sintomático (9).
El pronóstico del MM depende de una gran variedad de factores como la edad, el estado funcional, la presencia de comorbilidades, los índices proliferativos, la carga tumoral, o la estratificación determinada por el ISS (International Staging System), basado en los valores de álbumina y β2-microglobulina al diagnostico. La profundidad de la respuesta a la terapia inicial, especialmente la obtención de Remisión Completa (RC) y más recientemente, alcanzar valores indetectables de Enfermedad Mínima Residual (EMR) medida por citometría de flujo multiparamétrica o técnicas moleculares de alta sensibilidad son factores favorables que determinan mejor Supervivencia Libre de Progresión (SLP) y Superviencia Global (SG) (10-13).
Aunque el MM sigue siendo considerada un enfermedad incurable, análisis a muy largo plazo de cohortes de pacientes con MM tratados en los años 90 con quimioterapia convencional y trasplante autólogo han revelado curaciones operativas en aproximadamente un 35% de los pacientes que obtuvieron RC con aquellos tratamientos y hasta un 10% de pacientes con perfiles de progresión indolente tipo MGUS (gammapatía monoclonal de significado incierto) o MM no sintomático (14, 15). La mayor eficacia antitumoral asociada a la introducción de nuevos tratamientos ha dado lugar a una mejora en la supervivencia y en la calidad de vida de los pacientes (16), aunque conocer la curabilidad del MM a largo plazo derivada del uso de los tratamientos actuales requiere tiempos de observación más prolongados. En cualquier caso, el objetivo del tratamiento del MM es lograr un control de la enfermedad lo más duradero.
En la actualidad hay 5 grupos principales de terapias aprobadas para el tratamiento del MM. Los agentes clásicos incluyen corticosteroides y quimioterapia con agentes alquilantes (melfalán o ciclofosfamida) o antraciclinas (adriamicina o doxorrubicina liposomal) utilizados en esquemas de quimioterapia convencional, asociados a los nuevos fármacos, y, algunos de ellos, en regímenes de acondicionamiento a dosis mieloablativas en el contexto de trasplante autólogo de precursores hematopoyéticos. Entre los nuevos agentes ya autorizados se incluyen los inmunomoduladores (talidomida, lenalidomida y pomalidomida), inhibidores del proteasoma (bortezomib, carfilzomib) e inhibidores de histona deacetilasa (panobinostat).
El pronóstico de las recaídas en el MM, depende entre otros, de los factores pronósticos individuales de cada paciente, incluido el perfil citogenético al diagnóstico, de la historia terapéutica previa, del tiempo a la progresión a la respuesta inicial, o a la respuesta anterior en casos con múltiples episodios de recaída/ progresión. Estas circunstancias, impiden la definición de un estándar de tratamiento generalmente aceptado de los pacientes con MM en recaída/ progresión.
PANOBINOSTAT (FARYDAK ® )
Panobinostat, en combinación con bortezomib y dexametasona, ha sido autorizado para el tratamiento de pacientes adultos con mieloma múltiple refractario y/o en recaída que han recibido al menos dos tratamientos previos con bortezomib y un agente inmunomodulador (IMiD) (17).
La dosis inicial recomendada de panobinostat es de 20 mg, administrados por vía oral una vez al día, los días 1, 3, 5, 8, 10 y 12 de un ciclo de 21 días. La dosis recomendada de bortezomib es 1,3 mg/m2 vía intravenosa los días 1, 4, 8 y 11 del ciclo de 21 días. La dosis recomendada de dexametasona es 20 mg por vía oral los días 1, 2, 4, 5, 8, 9, 11 y 12 de cada ciclo de 21 días. Este esquema de tratamiento se recibe un máximo de 8 ciclos.
Se recomienda que los pacientes que obtengan beneficio clínico continúen el tratamiento durante ocho ciclos adicionales. Para los ciclos 9 a 16, la dosis y la pauta recomendada de panobinostat no se modifica (20 mg, días 1, 3, 5, 8, 10 y 12 de un ciclo de 21 días), mientras que bortezomib se administra los día 1 y 8 y dexametasona los días 1, 2, 8 y 9 de cada ciclo de 21 días.
Puede ser necesario modificar la dosis y/o la pauta de tratamiento en función de la tolerancia individual. Si se requiere una reducción de la dosis de panobinostat, ésta se reducirá en fracciones de 5 mg. La dosis no debe reducirse por debajo de 10 mg y debe mantenerse el mismo esquema de tratamiento (ciclo de tratamiento de 21 días).
La duración total del tratamiento puede ser de hasta 16 ciclos (48 semanas).
Se dispone de cápsulas duras de panobinostat de 10 mg, 15 mg y 20 mg.
Farmacología
Panobinostat es un inhibidor de histona deacetilasa (HDAC), que inhibe la actividad enzimática de la HDAC en concentraciones nanomolares. La HDAC cataliza la eliminación de los grupos acetilo de los residuos de lisina de histonas y de algunas proteínas no histonas. Como resultado de la inhibición de la actividad de HDAC, aumenta la acetilación de histonas, se produce una alteración epigenética que resulta en una relajación de la cromatina, que activa la transcripción (18). La sobreexpresión de deacetilasa (DACs) ha sido observada en MM y se asocia con malos resultados (19). In vitro, panobinostat produjo la acumulación de histonas acetiladas y otras proteínas, produciendo detención del ciclo celular y/o apoptosis de algunas células transformadas. Panobinostat mostró una mayor citotoxicidad en las células tumorales en comparación con las células normales.
El tratamiento de células tumorales con panobinostat provoca un aumento dosis dependiente de la acetilación de histonas H3 y H4, tanto in vitro como en modelos preclínicos en animales con xenoinjertos, lo que demuestra una inhibición consistente de la diana. Por otro lado, la exposición a panobinostat desencadenó una expresión incrementada del gen supresor del tumor p21CDKNIA (inhibidor de la quinasa dependiente de ciclina 1/p21), mediador clave en la detención en G1 y en la diferenciación.
Panobinostat también ha mostrado que actúa de forma sinérgica con bortezomib. Esta sinergia se puede explicar, en parte, a través del efecto de panobinostat sobre la degradación de proteínas.
Las células con MM tienen altos niveles de rotación de proteínas y por tanto son susceptibles a los inhibidores de proteosomas, que inhiben el metabolismo y eliminación de las proteínas generadas dentro de la célula y a través de este mecanismo producen una señal proapoptótica.
Bortezomib inhibe la degradación del proteosoma e induce la formación del agresoma (vía alternativa para la degradación de proteínas) que es transportado mediante microtúbulos a un autofagosoma donde es degradado por los lisosomas. La inhibición de la HDAC6, por parte de panobinostat, conduce a la hiperacetilación de los microtúbulos y a una degradación ineficaz del agresoma.
La coadministración de bortezomib y panobinostat, y la inhibición simultánea de las vías del proteosoma y agresora, da como resultado la citotoxicidad sinérgica.
Eficacia
El programa de desarrollo clínico para panobinostat incluyó 3 ensayos clínicos que fueron la base para determinar el uso del panobinostat en la indicación aprobada: el estudio B2207 (fase Ib, de escala de dosis para determinar la dosis máxima tolerada), el estudio pivotal D2308 (Panorama 1) y el estudio de soporte DUS71 (Panorama II) (18).
Estudio pivotal D2308 - Panorama 1: Eficacia clínica en pacientes con mieloma múltiple en recaída y en recaída y refractario (18)
Este estudio fase III, aleatorizado, doble ciego, controlado con placebo y multicéntrico, evaluó la eficacia y seguridad de panobinostat en combinación con bortezomib y dexametasona, en pacientes con MM en recaída o en recaída y refractario que habían recibido entre una y tres líneas previas de tratamiento para MM.
Los pacientes se aleatorizaron 1:1 en los brazos de tratamiento siguientes:
• Panobinostat + bortezomib + dexametasona (N=381).
• Placebo + bortezomib + dexametasona (N=387).
Se incluyeron pacientes con diagnóstico documentado de MM con enfermedad mensurable, basado en definiciones de 2003 del IMWG, que cumplieran los siguientes criterios: 1) presencia de proteína M en suero o en orina de 24 horas (proteína-M sérica >1 g/dl o proteína-M en orina >200 mg/24 horas), 2) plasmocitoma demostrado por biopsia o presencia células plasmáticas clonales en medula ósea ≥10% y 3) criterios relacionados con el deterioro de órganos o tejidos (CRAB, calcio elevado, insuficiencia renal, anemia, lesiones óseas). Además los pacientes debían haber recibido de 1 a 3 líneas previas de tratamiento que requirieran repetir el tratamiento para mieloma (criterios IMWG 2003). Los pacientes debían presentar un estado funcional según ECOG ≤2.
Se excluyeron del estudio a los pacientes que hubieran progresado en todas las líneas previas de tratamiento para MM refractario primario, a los pacientes que hubieran sido refractarios al tratamiento previo con bortezomib, pacientes que hubieran recibido tratamiento previo con inhibidores de histona incluyendo panobinostat, que precisaran el ácido valpróico para cualquier condición médica durante el estudio o dentro de los 5 días previos del inicio del tratamiento del estudio o con alteraciones cardiovasculares graves, clínicamente significativas y no controladas. Tampoco se permitió la participación en el estudio de pacientes con neuropatía periférica de grado ≥2 o, en caso de neuropatía grado 1, con dolor en los 14 días previos a la aleatorización.
En la fase de tratamiento 1 (TP1) la duración de un ciclo de tratamiento fue de 21 días, administrándose un total de 8 ciclos (24 semanas). Los pacientes recibieron panobinostat por vía oral (20 mg) o placebo una vez al día, los días 1, 3, 5, 8, 10 y 12 y bortezomib por vía intravenosa (1,3 mg/m 2 ) los días 1, 4, 8 y 11, de un ciclo de 21 días, y dexametasona por vía oral (20 mg) una vez al día, el mismo día y el día posterior a la administración de bortezomib.
Los pacientes que obtuvieron un beneficio clínico en la primera fase de tratamiento y no hubieran presentado efectos adversos CTCAE ≥ grado 2, pasaron a la fase de tratamiento 2 (TP2), que comenzó en el ciclo 9. La duración de un ciclo de tratamiento en esta fase fue de 42 días, administrándose un máximo de 4 ciclos (24 semanas). Los pacientes recibieron el mismo régimen de dosificación, aunque la frecuencia fue menor para bortezomib/dexametasona.
La variable principal de eficacia fue la SLP según los criterios modificados del Grupo Europeo de Trasplante de Médula Ósea (mEBMT) y la evaluación del investigador. Entre las variables secundarias se incluyeron la SG, la tasa de respuesta global (TRG) [que comprende a su vez la respuesta completa (RC), la respuesta casi completa, (RCc) y la respuesta parcial (RP)], tiempo hasta la respuesta (TR), duración de la respuesta (DR), tiempo de progresión o recaída (TP), cuestionarios de calidad de vida y seguridad. La SLP/TRG fue confirmada por un Comité de revisión independiente.
Un total de 768 pacientes fueron aleatorizados (1:1) para recibir panobinostat + bortezomib + dexametasona (n=387) o placebo + bortezomib + dexametasona (n=381). La aleatorización se estratificó según el uso previo de bortezomib [sí (n=336 (43,8%)) vs. no (n=432 (56,3%))] y el número de líneas de tratamiento previas para el mieloma [1 línea previa (n=352 (45,8%)), 2 a 3 líneas previas (n=416 (54,2%))]. Tanto las características demográficas como la condición inicial de la enfermedad fueron similares y comparables en ambos brazos del estudio. A los pacientes del grupo placebo no se les permitió el cruce al grupo de panobinostat.
Las características basales de los pacientes fueron similares en los 2 brazos de tratamiento. La mediana de edad fue de 63 años (rango 28-84). El 53% de los pacientes fueron varones y el 65% de raza caucásica, el 30,2% asiática y el 2,9% de raza negra. La mayoría de los pacientes tenían un estado funcional según ECOG entre 0 (43,9%) y 1 (49,1%) y el 42,1% eran ≥ 65 años. El 40,1% de los pacientes presentaba MM estadio I de ISS, 25,5% estadio II y 21,2% estadio III. El 68,4% de los pacientes presentaban riesgo citogenético normal.
La mediana del número de tratamientos previos fue de 1 (1-4); un 51% recibió una línea previa, el 30,2% de los pacientes recibieron 2 líneas previas de tratamiento y un 18,1% recibió 3 líneas previas. Un 78,4% de los pacientes no había recibido tratamiento previo con radioterapia y 57,2% habían recibido trasplante de progenitores hematopoyéticos con anterioridad y el 62,8% habían recaído después de haber recibido otros tratamientos antineoplásicos. Las terapias antineoplásicas previas más comunes fueron melfalán 79,6%, dexametasona 81,1%, talidomida 51,2%, ciclofosfamida 45,3%, bortezomib 43%, la combinación de bortezomib y dexametasona 37,8% y lenalidomida 20,4%. Más de un tercio de los pacientes estaban en recaída y eran refractarios al tratamiento anterior (35,8%).
El análisis final de eficacia se llevo a cabo con 460 eventos, la mediana de la SLP según la revisión del investigador (variable principal) fue de 12 meses en el grupo panobinostat + bortezomib + dexametasona y 8,1 meses en el grupo placebo + bortezomib + dexametasona [HR 0,63, IC95% (0,52; 0,76)]. La diferencia en la mediana de la SLP fue de 3,9 meses a favor del brazo de panobinostat. Según la revisión del comité independiente, se obtuvo un HR 0,69, IC95% (0,58; 0,83) para SLP, con una mediana de 10 vs. 7,7 meses; diferencia de 2,3 meses a favor de panobinostat. Los resultados de SLP se observan en la figura 1.
Figura 1. Gráficos Kaplan-Meier de supervivencia libre de progresión y supervivencia global en el conjunto del estudio pivotal.
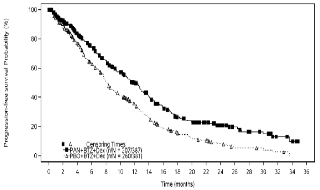
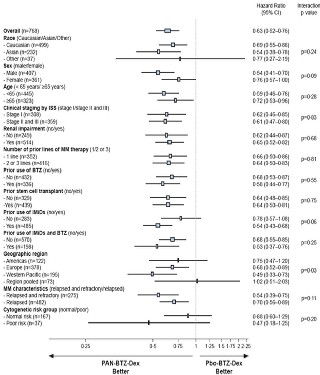
Los resultados de todos los subgrupos pre-especificados fueron consistentes con el resultado global, salvo para la región geográfica (p=0,03; Europa muestra resultados similares al global del estudio) y la utilización previa de IMiD (p=0,06) (figura 2).
El análisis final de la SG variable secundaria clave, realizada después de 415 eventos,%, la mediana de la SG fue de 40,28 meses en el brazo experimental (panobinostat + bortezomib + dexametasona) vs. 35,78 meses en brazo control (placebo + bortezomib + dexametasona) [HR 0,94, IC 95% (0,78; 1,14; p = 0,5435)].
Figura 2. Estudio D2308: Supervivencia Libre de progresión (SLP) por subgrupos según criterios modificados del grupo Europeo de Trasplante de Médula Ósea (mEBTM), evaluación del investigador. EBTM: Grupo Europeo de Trasplante de Médula Ósea
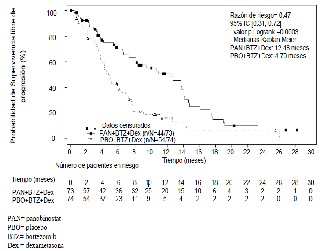
En el subgrupo de la indicación autorizada (pacientes adultos con mieloma múltiple refractario y/o en recaída que han recibido al menos dos tratamientos previos con bortezomib y un agente inmunomodulador; n=147) la media de la duración del tratamiento fue de 4,5 meses en el brazo de panobinostat + bortezomib + dexametasona (N=73) y de 4,8 meses en el brazo placebo + bortezomib + dexametasona (N=74). La mediana de SLP fue de 12,5 meses en el brazo con panobinostat y 4,7 meses en el brazo con placebo [HR 0,47, IC95% (0,31; 0,72)] (figura 3).
La tasa de respuesta fue del 59% frente a un 39% (panobinostat + bortezomib + dexametasona vs. placebo + bortezomib + dexametasona respectivamente). En cuanto a los datos de SG en la población de la indicación (n=147) la mediana de la SG fue de 25,5 meses en los pacientes del brazo panobinostat + bortezomib + dexametasona vs. 19,5 meses en los pacientes del brazo placebo + bortezomib + dexametasona [HR 0,84, IC95% (0,55; 1,27)].
Estudio DUS71 – Panorama 2 : Eficacia clínica en pacientes con mieloma múltiple refractario a bortezomib (18)
Como estudio de soporte se realizó el estudio DUS71, fase II bifásico, de un solo brazo, multicéntrico y abierto. Se administró panobinostat por vía oral (20 mg) en combinación con bortezomib intravenoso (1,3 mg/m 2 ) y dexametasona oral (20 mg) en 55 pacientes con MM en recaída y refractario, que habían sido refractarios a bortezomib y habían recibido al menos dos líneas previas de tratamiento. Los pacientes tenían que haber estado previamente expuestos a un agente IMiD (lenalidomida o talidomida). Se definió la refractariedad a bortezomib como la progresión de la enfermedad durante el tratamiento o en los 60 días posteriores a la última línea de tratamiento con bortezomib.
Figura 3. Gráfico Kaplan-Meier de supervivencia libre de progresión en pacientes con mieloma múltiple que recibieron al menos dos tratamientos previos con bortezomib y un agente inmunomodulador
La variable principal en este estudio fue determinar la TRG al cabo de 8 ciclos de tratamiento según los criterios mEBMT.
Los pacientes habían recibido tratamientos y regímenes múltiples con anterioridad (mediana: 4; rango: 2-11). Los 55 pacientes habían sido tratados con bortezomib y al menos un agente IMiD (lenalidomida: 98,2%, talidomida: 69,1%). La mayoría de los pacientes habían recibido un trasplante previo (63,6%).
La mediana de la duración de la exposición a la medicación del estudio fue de 4,6 meses (rango 0,1-24,1 meses). Los pacientes alcanzaron una TRG (≥RP (respuesta parcial) de 34,5% y 52,7% (≥ RM (respuesta mínima). La mediana del tiempo transcurrido hasta la respuesta (TR) fue de 1,4 meses y la mediana de la duración de la respuesta (DR) fue de 6 meses. La mediana de la SLP y TTP fueron ambos de 5,4 meses. La mediana de la SG fue de 17,5 meses.
Al no haberse obtenido datos de SG maduros, se solicitó a la compañía llevar a cabo un estudio postautorización para valorar la SG, las muertes a los 8 meses y datos del subgrupo de pacientes con tratamiento previo con IMiD y bortezomib.
Seguridad
El perfil de seguridad de panobinostat ha sido determinado sobre una base de 3 estudios con un total de 451 pacientes con MM tratados con panobinostat en combinación con bortezomib y dexametasona y de un total de 278 pacientes con otras neoplasias hematológicas y tumores sólidos tratados con panobinostat como agente único, de los cuales 381 pacientes fueron tratados en el estudio pivotal D2308, 15 en la fase de expansión del estudio B2207 y 55 en el estudio DUS71 (18).
En el estudio pivotal D2308, la mediana de duración de la exposición al tratamiento fue mayor en el grupo de placebo + bortezomib + dexametasona en comparación con el grupo de panobinostat + bortezomib + dexametasona (6,7 meses y 5,4 meses, respectivamente). Los datos del estudio revelan que la adición de panobinostat al tratamiento con bortezomib y dexametasona afecta a la tolerabilidad de la combinación panobinostat + bortezomib + dexametasona, de forma desfavorable.
Aunque la proporción de pacientes con al menos un evento adverso (EA) en el estudio D2308 fue similar para ambos brazos de tratamiento, el brazo de panobinostat + bortezomib + dexametasona tuvo una mayor proporción de efectos adversos grado 3/4 frente al brazo control placebo + bortezomib + dexametasona (96% vs. 82% respectivamente), de reacciones adversas graves (60% vs. 42% respectivamente), de efectos adversos que condujeron a la discontinuación del tratamiento (36% vs. 20% respetivamente ), y a la reducción o interrupción temporal del tratamiento (89% vs. 76% respectivamente), así como de muertes durante el tratamiento (8% vs. 5% respectivamente).
Los efectos adversos de cualquier grado más frecuentes fueron los hematológicos, principalmente trombocitopenia (51%), neutropenia (22%) y anemia (26%). Las reacciones adversas no hematológicas más frecuentes fueron diarrea (51%), náuseas (23%), vómitos (16%) y fatiga (31%). Los efectos cardiacos (más frecuentemente fibrilación auricular, taquicardia, palpitación y taquicardia sinusal) se notificaron en el 17,6% de los pacientes tratados con panobinostat + bortezomib + dexametasona frente al 9,8% de los pacientes tratados con placebo + bortezomib + dexametasona. Se han notificado anormalidades en el electrocardiograma (ECG) en pacientes tratados con panobinostat + bortezomib + dexametasona, principalmente depresión en el segmento ST-T (21,7%) y cambios en la onda T (39,6%) (17).
En el estudio PANORAMA 1, los efectos adversos más frecuentes considerados como relacionados con el tratamiento fueron trombocitopenia (51% vs. 29%), diarrea (51% vs. 25%), fatiga (31% vs 22%) anemia (25.5% vs 16%) nauseas (23% vs 12%) y neutropenia (22%% vs. 7%) Panobinostat vs placebo respectivamente.
Entre los efectos adversos que más frecuentemente obligaron a la discontinuación del tratamiento en comparación con el brazo control fueron: diarrea (4,5% vs. 1,6%), fatiga (2,9% en ambos brazos), astenia (2,9% vs. 0) y neuropatía periférica (3,7% vs. 1,9%). Las principales causas para la interrupción temporal del fármaco del estudio o para el ajuste de la dosis en comparación con el brazo control se referían a trombocitopenia (31% vs. 11%), diarrea (26% vs. 9%), fatiga (16% vs. 7%) y neumonía (11% vs. 8%).
En el estudio pivotal D2308, un 7,9% de los pacientes del brazo de tratamiento con panobinostat + bortezomib + dexametasona frente a un 4,8% del brazo con placebo + bortezomib + dexametasona murieron durante el periodo de tratamiento, siendo las principales causas de muerte: infecciones e infestaciones (1,8% vs. 1,3%), trastornos respiratorios, torácicos y mediastínicos (1,6% vs. 0,5%), trastornos cardiacos (1,0% vs. 0,8%) y la indicación del estudio (1,0% vs. 1,6%). Se registraron muertes no debidas a la indicación de estudio (MM) en el 6,8% de los pacientes tratados con panobinostat + bortezomib + dexametasona frente al 3,2% de los tratados con placebo + bortezomib + dexametasona. La incidencia de muertes no relacionadas con la indicación de estudio fue del 8,8% en pacientes ≥ 65 años en comparación con el 5,4% en pacientes < de 65 años (17). En el subgrupo de pacientes que recibieron al menos dos regímenes anteriores incluyendo bortezomib y un IMiD, las muertes durante el tratamiento fueron comparables entre los dos brazos de tratamiento (6,9% en el brazo con panobinostat vs. 6,8% en el brazo con placebo).
Debido al complicado régimen posológico para el tratamiento con panobinostat + bortezomib + dexametasona, y los posibles errores de medicación que podrían ocasionarse durante su administración, el Titular de la autorización de comercialización monitorizará mediante un estudio observacional no intervencionista el uso de panobinostat en pacientes con MM en recaída y/o refractarios: hemorragia severa, infecciones graves (incluyendo sepsis y neumonía), diarrea severa, uso en pacientes de edad avanzada (> de 65 años), cardiopatía isquémica, tromboembolismo venoso, segundas neoplasias, errores de medicación, uso en pacientes con insuficiencia hepática y/o renal.
En general, en el perfil de seguridad predominan los efectos adversos como diarrea, trombocitopenia, hemorragia, neutropenia e infecciones. Los pacientes del grupo experimental panobinostat + bortezomib + dexametasona en comparación con el grupo control placebo + bortezomib + dexametasona experimentaron una disminución transitoria en la calidad de vida durante los primeros 8 ciclos de tratamiento, sin embargo dicha disminución fue transitoria y esperable a la vista del perfil de toxicidad.
DISCUSIÓN
La mayoría de los pacientes con enfermedad recidivante responde a la quimioterapia adicional, pero la duración y la calidad de la respuesta son generalmente inferiores a las de la respuesta inicial y se acortan progresivamente con cada régimen sucesivo (20).
La mayoría de los pacientes con MM presentan episodios de recaída o progresión de la enfermedad a lo largo de su evolución, sólo algunos pacientes obtienen respuestas duraderas, con SLP prolongadas. En caso de recaída, la elección de tratamiento dependerá de múltiples factores como son la edad del paciente y comorbilidades, el tipo de tratamientos previos, así como la respuesta y tolerancia terapéutica, el número de líneas de tratamientos previos y el tiempo desde el último tratamiento. El objetivo del tratamiento es alcanzar la máxima respuesta con la mínima toxicidad.
Los pacientes que recaen tras bortezomib y lenalidomida tienen mal pronóstico con una SG de 6 meses (21). En las segundas y subsecuentes recaídas y una vez los pacientes ya han sido expuestos a bortezomib e IMiDs, las opciones de tratamiento son realmente muy limitadas. Repetir el mismo tratamiento es una opción a tener en cuenta para pacientes con una respuesta duradera durante más de 20 a 24 meses después del tratamiento de inducción tras el diagnóstico y más de 9 a 12 meses después del tratamiento en la recaída. En el caso de remisión o progresión a corto plazo tras la terapia inicial, se sugiere un régimen alternativo.
Los factores pronósticos más importantes en el tratamiento de los pacientes con recaída o mieloma refractario son la calidad y la duración de la respuesta a la terapia anterior, así una respuesta completa al tratamiento previo puede justificar la repetición del tratamiento en las recaídas posteriores. En general, el pronóstico de los pacientes con enfermedad refractaria a los IMiDs e inhibidores de proteosomas (IP) es pobre; entre este grupo, sólo aproximadamente el 22% responden a la terapia posterior, y entre los que no responde, la mediana de supervivencia libre de eventos (SLE) es <5 meses y entre los pacientes que llegan a ser refractarios a bortezomib y refractarios o no elegibles para talidomida y lenalidomida, la esperanza de vida alcanza una mediana de 9 meses (22). Por lo tanto, hay una necesidad de nuevos tratamientos, particularmente aquellos con mecanismos de acción que sean distintos de los de IMiDs y los IP (23). Hasta el momento, no existe un consenso sobre cuál es la mejor terapia tras fracaso a lenalidomida o bortezomib en MM. La elección del tratamiento posterior se hace en base a las terapias que el paciente ya ha recibido previamente y el perfil de efectos secundarios.
Las combinaciones de dexametasona y bortezomib o lenalidomida o bortezomib más doxorubicina pegilada liposomal, se han utilizado para el tratamiento del MM refractario o recidivante (24). Análisis retrospectivos indican que estos agentes dan mejores resultados en la primera recaída que en las posteriores. La media de supervivencia en este tipo de pacientes que han recibido terapia convencional es de unos 9 meses (22). La talidomida se puede considerar en pacientes con alteraciones hematológicas, dada su limitada toxicidad hematológica, bortezomib en pacientes con insuficiencia renal o con trombosis venosa profunda previa y lenalidomida en pacientes con neuropatía periférica concomitante (25).
Los pacientes que progresan con lenalidomida y dexametasona pueden responder a la adición de bortezomib. Los pacientes que progresan con bortezomib y dexametasona pueden responder a la adición de ciclofosfamida. Los pacientes cuya enfermedad progresa a pesar de un IMiD y bortezomib son candidatos a pomalidomida, panobinostat, carfilzomib o múltiples combinaciones.
La asociación de panobinostat con bortezomib y dexametasona en pacientes con mieloma múltiple refractario y/o en recaída ha mostrado ser superior a la combinación de bortezomib más dexametasona en términos de SLP, y con aumentos clínicamente significativos en los índices de respuesta completa y casi completa y en la duración de la respuesta. Sin embargo, los datos obtenidos por el comité independiente muestran un beneficio más modesto en términos de SLP, si bien esto podría ser debido a que no tuvieron en cuenta la confirmación de la progresión de la enfermedad.
Por otro lado, la combinación ha mostrado una toxicidad significativa, fundamentalmente con diarrea, astenia y trombocitopenia, que ha llevado a numerosas discontinuaciones del tratamiento. El efecto del panobinostat fue consistente en diversos subgrupos de pacientes, incluidos los de alto riesgo citogenético y aquellos en estadío avanzado de la enfermedad. Pese a todo y con un 86% de los eventos pre-especificados para el análisis final de SG, no se ha observado beneficio en la supervivencia.
La indicación aprobada de panobinostat (el de pacientes con al menos dos tratamientos previos, incluyendo bortezomib y un IMiD) se refiere a un subgrupo no pre-especificado que no parece presentar resultados distintos al global de la población del estudio Panorama 1 en cuanto a eficacia. Sin embargo, parece estar justificada, teniendo en cuenta la alta toxicidad asociada al régimen de panobinostat + bortezomib + dexametasona, junto con el beneficio de apenas 4 meses en términos de SLP y sin demostración de aumento significativo de la supervivencia. De esta forma, su indicación se dirige únicamente a aquellos pacientes en donde realmente existe una mayor necesidad no cubierta de nuevos tratamientos.
Por otro lado, el redactado de la indicación podría teóricamente estar incluyendo a aquellos pacientes refractarios a bortezomib, si bien la evidencia disponible no es muy alta. En primer lugar los pacientes que hubieran sido refractarios al tratamiento previo con bortezomib fueron excluidos del estudio pivotal, siendo el estudio Panorama 2 en donde podemos encontrar pacientes refractarios al mismo. En el estudio Panorama 2, se incluyeron pacientes con MM en recaída y refractario, que no habían respondido a bortezomib y habían recibido al menos dos líneas previas de tratamiento. En este estudio panobinostat ha mostrado una TRG del 34,5%, tasa similar a la obtenida por aquellos pacientes tratados con bortezomib y dexametasona (39%) en el subgrupo de pacientes que recibieron al menos dos tratamientos previos con bortezomib y un agente IMiD en el estudio pivotal (estudio que no permitió la inclusión de pacientes refractarios a bortezomib). Estos datos, podrían sugerir que la adición de panobinostat a la combinación de bortezomib y dexametasona podría revertir la refractariedad al tratamiento previo con bortezomib (definido como la progresión de la enfermedad en los 60 días posteriores a la última línea de tratamiento con bortezomib). No obstante, el hecho de que estos provengan de un estudio no comparado limita el poder obtener conclusiones a este respecto.
En relación a las alternativas existentes en la misma línea de tratamiento que ocuparía panobinostat, las opciones son la reintroducción de bortezomib sin añadir ese fármaco, o el uso de otro IMiD no utilizado previamente.
Respecto a pomalidomida, en el estudio pivotal fase III CC-4047- MM-003, la asociación de pomalidomida junto a dosis bajas de dexametasona en pacientes resistentes al tratamiento previo o pacientes recidivantes que hubieran recibido al menos dos tratamientos anteriores, incluyendo lenalidomida y bortezomib, mostró ser superior a dosis altas de dexametasona en términos de SLP y SG. La población reclutada en el estudio (pacientes con una mediana de 5 terapias previas, entre ellas un alquilante) representa un conjunto de pacientes con no muchas alternativas disponibles, dado que la mayoría (72%) eran refractarios tanto a lenalidomida como a bortezomib mientras que un 23,3% lo fueron a talidomida, lenalidomida y bortezomib. Para la población por intención de tratar, la mediana del tiempo de SLP según revisión del Independent Review Adjudication Committee (IRAC) basada en los criterios del IMWG fue de 15,7 semanas en el grupo de pomalidomida y dosis bajas de dexametasona (LD-dexametasona) [HR 0,45] (26). La mediana del tiempo de SG no fue alcanzado por el grupo pomalidomida + dosis bajas de dexametasona (27). Las principales reacciones adversas de pomalidomida fueron eventos tromboembólicos y neutropenia. Antes de decidir la discontinuación del tratamiento, estos efectos adversos pueden controlarse, con terapia de soporte (factores estimulantes y anticoagulantes) y con disminución de la dosis (28).
Si bien no se dispone de comparaciones directas de pomalidomida con panobinostat, existen diferencias entre los ensayos pivotales de pomalidomida y panobinostat que limitan la comparación indirecta entre los 2 ensayos. El estudio de panobinostat más bortezomib fue en pacientes no refractarios a bortezomib, que podían ser retratados con este fármaco. Este no es el caso del estudio pivotal de pomalidomida. En consecuencia, los comparadores son diferentes. Las variables principales seleccionadas difieren, mientras en el ensayo pivotal de pomalidomida la variable principal de eficacia fue la SLP según los criterios del Grupo Europeo de Trasplante de Médula Ósea (EMBT) en el de panobinostat se usaron los criterios modificados del Grupo Europeo de Trasplante de Médula Ósea (mEMBT). También los grupos de edad de las poblaciones difieren, mientras el de pomalidomida la estratificación fue ≤75 vs. >75 años con panobinostat fue ≤65 o >65 años. Pero la diferencia más importantes es la media de tratamientos previos con pomalidomida, que fue de 5,5, mientras que con panobinostat fue de 1,7 (en el estudio Panorama2 la media fue de 4). Por lo que atendiendo a las diferentes poblaciones reclutadas en los estudios clínicos, el régimen de panobinostat se situaría en un escalón previo al tratamiento con pomalidomida.
Por otro lado, en una revisión sistemática con 1.912 pacientes con MM en recaída o refractario, tratados con talidomida + dexametasona en 8 ensayos clínicos (n=283) y con talidomida en monoterapia en 42 ensayos clínicos (n=1.629), se reportó una mejor relación beneficio-riesgo de la combinación, con tasas de respuesta global del 51% con talidomida + dexametasona respecto del 29% con talidomida en monoterapia (29). Se puede considerar que la talidomida en combinación con dexametasona es un tratamiento de rescate efectivo, no produce citopenia y parece ser una opción en las etapas avanzadas de la enfermedad o en pacientes frágiles cuando el tratamiento está limitado por los efectos tóxicos hematológicos. A pesar de que no existen estudios que demuestren la eficacia de talidomida tras varias líneas de tratamiento, cabría esperar que pudiera ser una alternativa terapéutica a pomalidomida. No obstante desconocemos en qué medida la población incluida en estos estudios es similar a la población estudiada con panobinostat (líneas previas, tratamientos anteriores, etc.).
Finalmente, en el estudio APEX, fase III, multicéntrico, aleatorizado, abierto donde se compara bortezomib en monoterapia vs. dexametasona en 669 pacientes con MM que hubieran recibido de 1 a 3 tratamientos previos (corticoides, agentes alquilantes, antraciclinas, talidomida, alcaloides de la vinca, trasplante de células madre u otras terapias), pero no tratamiento previo con bortezomib, la diferencia de medianas del tiempo hasta progresión fue de 2,7 meses (6,2 vs. 3,5) HR: 0,55, p<0,001 (30).
CONCLUSIÓN
La indicación de panobinostat en asociación a bortezomib y dexametasona ya está centrada, como consecuencia de la alta toxicidad asociada a la combinación, en aquellos pacientes adultos con mieloma múltiple refractario y/o en recaída que han recibido al menos dos tratamientos previos con bortezomib y un agente IMiD, debido a que este tipo de pacientes podría tener mayor carencia de tratamientos alternativos.
No obstante, no existen datos suficientes para determinar el balance beneficio riesgo en pacientes refractarios a bortezomib (progresión de la enfermedad en los 60 días posteriores a la última línea de tratamiento con bortezomib).
El hecho de que panobinostat en asociación con bortezomib y dexametasona no haya demostrado por el momento un aumento de la supervivencia, unido a la elevada toxicidad de la combinación, genera dudas sobre la relevancia en práctica clínica de la combinación.
CONSIDERACIONES FINALES DEL GCPT
La Dirección general de Cartera Básica de Servicios del SNS y Farmacia ha emitido la resolución de no financiación para panobinostat (Farydak®).
REFERENCIAS
1. Kyle RA, Rajkumar SV. Criteria for diagnosis, staging, risk stratification and response assessment of Multiple Myeloma. Leukemia 2009.
2. International Agency for Research on Cancer (IARC). GLOBOCAN 2012 Database: Summary Table by Cancer. Disponible en:
http://www-dep.iarc.fr/. Último acceso noviembre de 2015.
3. Sabín P. Sociedad Española de Oncología Médica (SEOM) Disponible en:
http://www.seom.org/es/informacion-sobre-el-cancer/info-tipos-cancer/linfomas-y-mieloma/mieloma.
4. Asociación Española contra el Cáncer. Disponible en: https://www.aecc.es/SobreElCancer/CancerPorLocalizacion/mielomamultiple/Paginas/mielomamultiple.aspx.
5. Cancer Research UK. Myeloma Survival Statistics. Disponible a en:
http://www.cancerresearchuk.org/cancer- info/cancerstats/types/myeloma/survival/multiple-myeloma-survival-statistics. Último acceso noviembre de 2015.
6. Brenner H, Gondos A, Pulte D. Expected long-term survival of patients diagnosed with multiple myeloma in 2006–2010. Haematologica. 2009; 94:270–5.
7. Costa LJ, Gonsalves WI, Kumar SK. Early mortality in multiple myeloma. Leukemia. 2015;29: 1616-8.
8. Sociedad Española de Oncología Médica (SEOM).Las Cifras del Cáncer en España 2014.
http://www.seom.org/seomcms/images/stories/recursos/Las_cifras_del_cancer_2014.pdf.
9. Rajkumar SV, Dimopoulos MA, Palumbo A, Blade J, Merlini G, Mateos MV, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol 2014; 15: e538–48.
10. Kyle RA, Gertz MA, Witzig TE, et al. Review of 1027 patients with newly diagnosed multiple myeloma. Mayo Clin Proc. 2003; 78(1):21.
11. Greipp PR, San Miguel J, Durie BG, et al. International staging system for multiple myeloma. J Clin Oncol. 2005; 23(15):3412.
12. Russell SJ, Rajkumar SV. Multiple myeloma and the road to personalised medicine. Lancet Oncol. 2011; 12(7):617–619.
13. Mikhael JR, Dingli D, Roy V, et al. Management of newly diagnosed symptomatic multiple myeloma: updated mayo stratification of multiple myeloma and risk-adapted therapy (mSMART) consensus guidelines 2013. Mayo Clin Proc. 2013; 88(4):360–376.
14. Martinez-Lopez J , Blade J , Mateos MV , Grande C , Alegre A et al.
Long-term prognostic significance of response in multiple myeloma after stem cell transplantation. Blood. 2011 Jul 21;118(3):529-34.
doi: 10.1182/blood-2011-01-332320. Epub 2011 Apr 11.
15. Barlogie B , Mitchell A , van Rhee F , Epstein J , Morgan GJ , Crowley J . Curing myeloma at last: defining criteria and providing the evidence. Blood. 2014 Nov 13;124(20):3043-51. doi: 10.1182/blood-2014-07-552059. Epub 2014 Oct 7.
16. NICE guideline. Myeloma: diagnosis and management. 10 febrero 2016 (nice.org.uk/guidance/ng35 (Consultado febrero 2016).
17. Ficha técnica Farydak® (panobinostat): Disponible en:
http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_Product_Information/human/003725/WC500193298.pdf. (Consultado abril 2016).
18. European Public Assessment Report for Farydak® (panobinostat).
Disponible en:
http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_Public_assessment_report/human/003725/WC500193300.pdf. (Consultado septiembre 2015).
19. Mithraprabhu S, Kalff A, Chow A, Khong T, Spencer A.
Dysregulated class I histone deacetylases are indicators of poor prognosis in multiple myeloma. Epigenetics 2014;9:1511-20.
20. Moreau, P., San Miguel, J., Ludwig, H., Schouten, H., Mohty, M., Dimopoulos, M., ... & ESMO Guidelines Working Group. (2013). Multiple myeloma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of oncology, mdt297.
21. Richardson PG, Hungria VT, Yoon SS, Beksac M, Dimopoulos MA, Elghandour A,Jedrzejczak WW, Guenther A, Na Nakorn T, Siritanaratkul N, Schlossman RL, Hou J, Moreau P, Lonial S, Lee JH, Einsele H, Sopala M, Bengoudifa BR, Corrado C,Binlich F, San-Miguel JF. Panobinostat plus bortezomib and dexamethasone inrelapsed/relapsed and refractory myeloma: outcomes by prior treatment. Blood.2015 Dec 2. pii: blood- 2015-09-665018.
22. Kumar SK, Lee JH, Lahuerta JJ, Morgan G, Richardson PG, Crowley J, et al. Risk of progression and survival in multiple myeloma relapsing after therapy with IMiDs and bortezomib: a multicenter international myeloma working group study. Leukemia 2012;26:149-57.
23. Kumar SK, Dispenzieri A, Lacy MQ, Gertz MA, Buadi FK, Pandey S, et al. Continued improvement in survival in multiple myeloma: changes in early mortality and outcomes in older patients. Leukemia 2014;28:1122-8.
24. Ludwig H, Beksac M, Blade J et al. Multiple myeloma treatment strategies with novel agents in 2011:AEuropean perspective.The Oncologist 2011;16:388–40.
25. Palumbo, Antonio, et al. International Myeloma Working Group consensus statement for the management, treatment, and supportive care of patients with myeloma not eligible for standard autologous stem-cell transplantation. Journal of Clinical Oncology 32.6 (2014): 587-600.
26. Informe Público de Evaluación para pomalidomida. Disponible en:
http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_Public_assessment_report/human/002682/WC500147721.pdf. (Consultado Septiembre 2015).
27. MM-003(2): Miguel JS, Weisel K, Moreau P, Lacy M, Song K, Delforge M, Karlin L, Goldschmidt H, Banos A, Oriol A, et al. Pomalidomide plus low-dose dexamethasone versus high-dose dexamethasone alone for patients with relapsed and refractory multiple myeloma (MM-003): a randomised, open-label, phase 3 trial. Lancet Oncol. 2013 Sep 2.
28. AEMPS. Informe de Posicionamiento Terapéutico de Pomalidomida (Imnovid®). PT/V1/01022015. Disponible en:
http://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/IPT-pomalidomida-Imnovid.pdf. (Consultado septiembre 2015).
29. Glasmacher, A., Hahn, C., Hoffmann, F., Furkert, K., von Lilienfeld-Toal, M., Orlopp, et al. (2005, November). Thalidomide in Relapsed or Refractory Patients with Multiple Myeloma: Monotherapy or Combination Therapy? A Report from Systematic Reviews. In ASH Annual Meeting Abstracts (Vol. 106, No. 11, p. 5125).
30. Richardson PG, Sonneveld P, Schuster MW, Irwin D, Stadtmauer EA, Facon T, et al. Bortezomib or high-dose dexamethasone for relapsed multiple myeloma. N Engl J Med. 2005 Jun 16;352(24):2487–98.
GRUPO DE EXPERTOS
Agencia Española de Medicamentos y Productos Sanitarios
Comunidad Autónoma de Andalucía
Comunidad Autónoma de Castilla La Mancha
Todos los expertos han realizado una declaración de conflictos de interés.
El Laboratorio Titular, la Sociedad Española de Oncología Médica, la Sociedad Española de Farmacología Clínica, la Sociedad Española de Farmacia Hospitalaria y el Grupo Español de Pacientes con Cáncer han tenido oportunidad de enviar comentarios al documento, si bien el texto final es el adoptado por el GCP

