Las siguientes reacciones adversas graves se describen a continuación y en otras partes del etiquetado:
- Nefritis Tubuloinnersticial Aguda
- Diarrea Asociada a Clostridium difficile
- Fractura Ósea
- Reacciones adversas cutáneas graves [consulte Advertencias y precauciones
- Lupus Eritematoso Cutáneo y Sistémico
- Déficit de Cianocobalamina (Vitamina B12)
- Hipomagnesemia y Metabolismo Mineral
- Pólipos de glándulas fúndicas
- Riesgo de engrosamiento de las válvulas cardíacas en pacientes pediátricos menores de dos años
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un medicamento no se pueden comparar directamente con las tasas en los ensayos clínicos de otro medicamento y pueden no reflejar las tasas observadas en la práctica.
Adultos
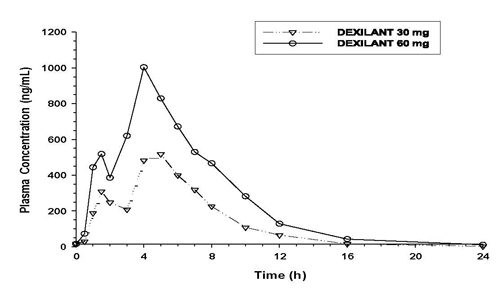
La seguridad de DEXILANT se evaluó en 4548 pacientes adultos en ensayos clínicos controlados y de un solo brazo, incluidos 863 pacientes tratados durante al menos seis meses y203 pacientes tratados durante un año. Los pacientes tenían edades comprendidas entre 18 y 90 años (mediana de edad 48 años), con 54% mujeres, 85% caucásicas, 8% negras, 4% asiáticas y 3% otras razas. Se llevaron a cabo seis ensayos clínicos controlados aleatorios para el tratamiento de EE, mantenimiento de EE curado y ERGE sintomática, que incluyeron 896 pacientes con placebo, 455 pacientes con DEXILANT 30 mg, 2218 pacientes con DEXILANT 60 mg y 1363 pacientes con lansoprazol 30 mg una vez al día.
Reacciones adversas comunes
En la Tabla 2 se presentan las reacciones adversas más comunes (> 2%) que ocurrieron con una mayor incidencia de DEXILANT que el placebo en los estudios controlados.
| Tabla 2. Reacciones Adversas comunes en Estudios Controlados en Adultos |
| Placebo
(N=896) | DEXILANT
30 mg
(N=455) | DEXILANT
60 mg
(N=2218) | DEXILANT
Total
(N=2621) | Lansoprazole
30 mg
(N=1363) |
| Reacción Adversa | % | % | % | % | % |
| Diarrea | 2.9 | 5.1 | 4.7 | 4.8 | 3.2 |
| Dolor Abdominal | 3.5 | 3.5 | 4.0 | 4.0 | 2.6 |
| Náusea | 2.6 | 3.3 | 2.8 | 2.9 | 1.8 |
| Infección del tracto respiratorio superior | 0.8 | 2.9 | 1.7 | 1.9 | 0.8 |
| Vómitos | 0.8 | 2.2 | 1.4 | 1.6 | 1.1 |
| Flatulencia | 0.6 | 2.6 | 1.4 | 1.6 | 1.2 |
Reacciones adversas que resultan en descontinuación
En estudios clínicos controlados, la reacción adversa más común que condujo a la interrupción de DEXILANT fue diarrea (0.7%).
Reacciones adversas menos comunes
Otras reacciones adversas que se informaron en estudios controlados con una incidencia de menos del 2% se enumeran a continuación por sistema corporal:
Trastornos de la sangre y del sistema linfático: anemia, linfadenopatía
Trastornos cardíacos: angina, arritmia, bradicardia, dolor torácico, edema, infarto de miocardio, palpitaciones, taquicardia.
Trastornos del oído y del laberinto: dolor de oído, tinitus, vértigo
Trastornos endocrinos: bocio
Trastornos oculares: irritación ocular, hinchazón ocular
Trastornos gastrointestinales: molestias abdominales, sensibilidad abdominal, hecesanormales, molestias anales, esófago de Barrett, bezoar, ruidos intestinales anormales, olor respiratorio, colitis microscópica, pólipo colónico, estreñimiento, boca seca, duodenitis, dispepsia, disfagia, enteritis, eructos, esofagitis, pólipo gástrico, gastritis, gastroenteritis, trastornos gastrointestinales, trastornos de hipermotilidad gastrointestinal, ERGE, úlceras gastrointestinales y perforación, hematemesis, hematoquecia, hemorroides, vaciamiento gástrico deteriorado, síndrome del intestino irritable, heces mucosas, ampollas en la mucosa oral, defecación dolorosa, proctitis, parestesia oral, hemorragia rectal, arcadas
Trastornos generales y condiciones del sitio de administración: reacción adversa almedicamento, astenia, dolor de pecho, escalofríos, sensación anormal, inflamación, inflamaciónde la mucosa, nódulo, dolor, pirexia
Trastornos hepatobiliares: cólico biliar, colelitiasis, hepatomegalia.
Trastornos del sistema inmunitario: hipersensibilidad
Infecciones e infestaciones: infecciones por cándida, gripe, nasofaringitis, herpes oral, faringitis, sinusitis, infección viral, infección vulvovaginal
Lesiones, intoxicaciones y complicaciones de procedimiento: caídas, fracturas, esguinces articulares, sobredosis, dolor de procedimiento, quemaduras solares
Investigaciones de laboratorio: aumento de ALP, aumento de ALT, aumento de AST, disminución / aumento de bilirrubina, aumento de creatinina en sangre, aumento de gastrina en sangre, aumento de glucosa en sangre, aumento de potasio en sangre, prueba de función hepática anormal, recuento de plaquetas disminuido, aumento de proteína total, aumento de peso
Trastornos del metabolismo y de la nutrición: cambios en el apetito, hipercalcemia, hipocalemia.
Trastornos musculoesqueléticos y del tejido conectivo: artralgia, artritis, calambres musculares, dolor musculoesquelético, mialgia.
Trastornos del sistema nervioso: alteración del gusto, convulsiones, mareos, dolores de cabeza, migraña, deterioro de la memoria, parestesia, hiperactividad psicomotora, temblor, neuralgia del trigémino
Trastornos psiquiátricos: sueños anormales, ansiedad, depresión, insomnio, cambios en la libido.
Trastornos renales y urinarios: disuria, urgencia miccional
Trastornos del sistema reproductor y de la mama: dismenorrea, dispareunia, menorragia, trastorno menstrual
Trastornos respiratorios, torácicos y mediastínicos: aspiración, asma, bronquitis, tos, disnea, hipo, hiperventilación, congestión del tracto respiratorio, dolor de garganta
Trastornos de la piel y del tejido subcutáneo: acné, dermatitis, eritema, prurito, erupción cutánea, lesión cutánea, urticaria
Trastornos vasculares: trombosis venosa profunda, sofocos, hipertensión
Las reacciones adversas adicionales que se informaron en un ensayo de brazo único a largo plazo y que el médico tratante consideró relacionadas con DEXILANT incluyeron: anafilaxia, alucinación auditiva, linfoma de células B, bursitis, obesidad central, colecistitis aguda, deshidratación, diabetes mellitus, disfonía, epistaxis, foliculitis, gota, herpes zoster, hiperlipidemia, hipotiroidismo, aumento de neutrófilos, disminución de MCHC, neutropenia, tenesmo rectal, síndrome de piernas inquietas, somnolencia, amigdalitis.
Pediatría
La seguridad de DEXILANT se evaluó en ensayos clínicos controlados y de un solo brazo que incluyeron 166 pacientes pediátricos, de 12 a 17 años de edad para el tratamiento de ERGE sin erosión sintomática, curación de EE, mantenimiento de EE curado y alivio de la acidez estomacal.
El perfil de reacción adversa fue similar al de los adultos. Las reacciones adversas más comunes que ocurrieron en ≥5% de los pacientes fueron dolor de cabeza, dolor abdominal, diarrea, nasofaringitis y dolor orofaríngeo.
Otras reacciones adversas
Consulte la información de prescripción completa para el lansoprazol para otras reacciones adversas no observadas con DEXILANT
Experiencia Post comercialización
Las siguientes reacciones adversas han sido identificadas durante la post-aprobación de Dexilant®. Debido a que estas reacciones se reportan voluntariamente por una población de tamaño incierto, no siempre es posible estimar de forma fiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Trastornos de la Sangre y del Sistema Linfático: anemia hemolítica autoinmune, púrpura trombocitopénica idiopática
Trastornos del oído y del laberinto: sordera
Trastornos oculares: visión borrosa
Trastornos gastrointestinales: edema bucal, pancreatitis, pólipos de glándulas fúndicas
Trastornos generales y condiciones del lugar de administración: edema facial
Trastornos hepatobiliares: hepatitis inducida por medicamentos
Trastornos del sistema inmunológico: shock anafiláctico (que requiere la intervención de emergencia), dermatitis exfoliativa, SJS/TEN (algunos fatales), DRESS, AGEP
Infecciones e infestaciones: diarrea asociada a Clostridium difficile
Trastornos metabólicos y nutricionales: hipomagnesemia, hipocalcemia, hipokalemia, hiponatremia
Trastornos del sistema músculo-esquelético: fractura ósea
Trastornos del sistema nervioso: accidente cerebrovascular, ataque isquémico transitorio
Trastornos renales y urinarios: Insuficiencia renal aguda
Trastornos respiratorios, torácicos y mediastínicos: Edema faríngeo, opresión en la garganta
Trastornos de la piel y del tejido subcutáneo: erupción generalizada, vasculitis leucocitoclástica